题目内容
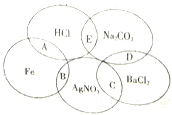
【题目】下图为一五元环图案,小明在图案上依次写了五种物质,图中相交的两种物质均可发生化学反应,A、B、C、D、E表示其相应的化学反应。
请回答下列问题:
(1)反应A、B、C、D、E中属于氧化还原反应的是_______(填字母)。
(2)根据已学过的知识及这5个反应比较H+、Fe2+、Ag+的氧化性强弱:_________。
(3)用洁净的烧杯取少量反应A后的溶液,用酒精灯小心加热至沸腾,发现可制得一种红褐色胶体。写出生成红褐色胶体的离子方程式:________。在加热过程中__ (填“有”或“没有”)电子转移。
【答案】 AB Ag+>H+>Fe2+ Fe3++3H2O ![]() Fe(OH)3(胶体)+3H+ 有
Fe(OH)3(胶体)+3H+ 有
【解析】试题分析:本题考查氧化还原反应的判断,氧化性强弱的比较,Fe(OH)3胶体的制备。
(1)反应A为Fe+2HCl=FeCl2+H2↑;反应B为Fe+2AgNO3=Fe(NO3)2+2Ag;反应C为2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2;反应D为BaCl2+Na2CO3=BaCO3↓+2NaCl;反应E为Na2CO3+2HCl=2NaCl+H2O+CO2↑;反应A、B都为置换反应,有元素化合价的升降,属于氧化还原反应;反应C、D、E都为复分解反应,没有元素化合价的升降,属于非氧化还原反应;答案选AB。
(2)在反应Fe+2HCl=FeCl2+H2↑中,H+作氧化剂,Fe2+是氧化产物,则氧化性:H+![]() Fe2+;在反应Fe+2AgNO3=Fe(NO3)2+2Ag中,Ag+作氧化剂,Fe2+是氧化产物,则氧化性:Ag+
Fe2+;在反应Fe+2AgNO3=Fe(NO3)2+2Ag中,Ag+作氧化剂,Fe2+是氧化产物,则氧化性:Ag+![]() Fe2+;根据金属活动性顺序表,氧化性:Ag+
Fe2+;根据金属活动性顺序表,氧化性:Ag+![]() H+;则H+、Fe2+、Ag+的氧化性强弱的顺序为Ag+>H+>Fe2+。
H+;则H+、Fe2+、Ag+的氧化性强弱的顺序为Ag+>H+>Fe2+。
(3)制得的红褐色胶体为Fe(OH)3胶体,制备Fe(OH)3胶体的离子方程式为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。反应A后的溶液为FeCl2溶液,其中Fe的化合价为+2价,加热制得的Fe(OH)3胶体中Fe的化合价为+3价,元素化合价有升降,所以加热过程中有电子转移。
Fe(OH)3(胶体)+3H+。反应A后的溶液为FeCl2溶液,其中Fe的化合价为+2价,加热制得的Fe(OH)3胶体中Fe的化合价为+3价,元素化合价有升降,所以加热过程中有电子转移。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】空气中含有吸入颗粒物PM2.5,严重影响人的生理和健康,因此改善发质结构、机动车辆措施能有效减少PM2.5、SO2、NO3等的污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下,测得该试样的组成及其浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断,该试样的pH = ________。
(2)汽车尾气中NOx和CO的生成。已知:气缸中生成NO的反应为N2(g)+O2(g)![]() 2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
A.混合气体的密度不再变化 B.混合气体的平均分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的转化率不再变化
E.生成lmol N2的间时有lmol O2被消耗
(3)为减少CO2、SO2的排放,常采取的措施如下:
①将煤转化为淸洁气体燃料。己知:H2(g)+1/2O2(g)= H2O(g) △H =-241.8kJ mol-1; C(s)+1/2O2(g)=CO(g) △H =-110.5kJ mol-1。写出焦炭与水蒸气反应的热化学方程式:_____________________________________。
②洗涤含SO2的烟气。下列物质,可作为洗涤含SO2烟气的洗涤剂的是______(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl3饱和溶液 D.酸性CaCl2饱和溶液
(4)某湿度下,反应2NO(g)+O2(g) ![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
判断的依据是__________________________________。
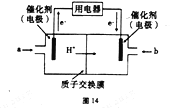
(5)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池的工作原理如图14所示,则通入a气体的电极,电极反应式为_________________。
(6)—定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为___________________。