题目内容
【题目】空气中含有吸入颗粒物PM2.5,严重影响人的生理和健康,因此改善发质结构、机动车辆措施能有效减少PM2.5、SO2、NO3等的污染。请回答下列问题:
(1)将一定量的某PM2.5样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下,测得该试样的组成及其浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3﹣ | Cl﹣ |
浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断,该试样的pH = ________。
(2)汽车尾气中NOx和CO的生成。已知:气缸中生成NO的反应为N2(g)+O2(g)![]() 2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
2NO(g) △H>0。恒温,恒容密闭容器中,下列叙述,能说明该反应达到化学平衡状态的是________ (填序号)。
A.混合气体的密度不再变化 B.混合气体的平均分子质量不再变化
C.N2、O2、NO的物质的量之比为1:1:2 D.氧气的转化率不再变化
E.生成lmol N2的间时有lmol O2被消耗
(3)为减少CO2、SO2的排放,常采取的措施如下:
①将煤转化为淸洁气体燃料。己知:H2(g)+1/2O2(g)= H2O(g) △H =-241.8kJ mol-1; C(s)+1/2O2(g)=CO(g) △H =-110.5kJ mol-1。写出焦炭与水蒸气反应的热化学方程式:_____________________________________。
②洗涤含SO2的烟气。下列物质,可作为洗涤含SO2烟气的洗涤剂的是______(填序号)。
A.浓氨水 B.碳酸氢钠饱和溶液 C.FeCl3饱和溶液 D.酸性CaCl2饱和溶液
(4)某湿度下,反应2NO(g)+O2(g) ![]() 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积, 平衡将_____(填“正反应方向” “逆反应方向”或“不”)移动。
判断的依据是__________________________________。
(5)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池的工作原理如图14所示,则通入a气体的电极,电极反应式为_________________。

(6)—定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与bmol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为___________________。
【答案】 4 DE C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol1 ABC 不 保证c(O2)不变的情况下,增大容器体积,c(NO2)与c(NO)同等倍数减小,其浓度商不变,所以平衡不移动 CH3OH6e+H2O=CO2+6H+ ![]()
【解析】(1)观察表格中发现NH4+水解显酸性,试样的pH值根据溶液中电荷守恒计算氢离子浓度为10-4mol/L,pH=-lgc(H+)=-lg10-4=4;(2) A.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,混合气体的密度不再变化不能说明反应达到平衡状态,A错误;B. 混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,物质的量也不变,所以混合气体的平均分子质量不再变化不能说明反应达到平衡状态,B错误;C.N2、O2、NO的物质的量之比为1∶1∶2不能说明正逆反应速率相等,不能据此说明反应达到平衡状态,C错误;D.氧气的转化率不再变化说明正逆反应速率相等,反应达到平衡状态,D正确;E.生成lmol N2的间时有lmol O2被消耗说明正逆反应速率相等,达到平衡状态,E正确;答案选DE。(3) ①已知:ⅰ、H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ·mol-1,ⅱ、C(s)+1/2O2(g)=CO(g)△H=-110.5kJ·mol-1,利用盖斯定律,将ⅱ-ⅰ可得C(s)+H2O(g)=CO(g)+H2(g)△H=(-110.5kJmol-1)-(-241.8kJmol-1)=+131.3 kJmol-1;②洗涤含SO2的烟气,根据酸性氧化物的性质选浓氨水和碳酸氢钠饱和溶液,另外氯化铁能氧化SO2,也可以吸收SO2,SO2和氯化钙溶液不反应,答案选ABC;(4)由于保证c(O2)不变的情况下,增大容器体积,c(NO2)与c(NO)同等倍数减小,其浓度商不变,所以平衡不移动;(5)根据原电池的工作原理,电子从负极经外电路流向正极,即左端电极为负极,通入的是CH3OH,根据示意图,电池内部有H+转移,说明环境是酸性,因此负极反应式为CH3OH+H2O-6e-=CO2↑+6H+。(6)依据电荷守恒有c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-),2c(Ba2+)=c(CH3COO-),推出c(H+)=c(OH-),溶液显中性,则Ka=c(CH3COO-)×c(H+)/c(CH3COOH)=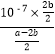 =10-7×2b/(a-2b)。
=10-7×2b/(a-2b)。




