题目内容
Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为 而后又发生反应的离子方程式为
在(Ⅱ)中煮沸溶液的目的是
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是 。
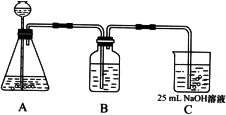
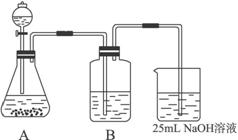
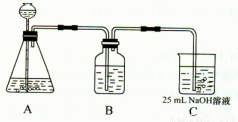
(2)按该同学的设计,第(I)步实验装置如下:
①装置A使用的试剂是 (固体)和 ;
②装置B使用的试剂最好是 (选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是 ,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有 。
(13分)(1)2NaOH+ CO2= Na2CO3+H2O(1分)
CO32-+H2O+ CO2=2HCO3-(2分)
除去过量或多余的CO2气体,防止碳酸氢钠分解。(2分)
OH-+ HCO3-= CO32-+H2O(2分)
(2)①石灰石 盐酸(各1分) ②饱和碳酸氢钠溶液
除去CO2气体中混有的HCl气体(各1分)
NaCl NaOH (各1分)
解析试题分析:
在(I)中,刚通入CO2时发生的反应化学方程为2NaOH+ CO2= Na2CO3+H2O而后又发生反应的离子方程式为CO32-+H2O+ CO2=2HCO3-
在(Ⅱ)中煮沸溶液的目的是除去过量或多余的CO2气体,防止碳酸氢钠分解。
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是OH-+ HCO3-= CO32-+H2O;①装置A使用的试剂是石灰石(固体)和盐酸;
②装置B使用的试剂最好是饱和碳酸氢钠溶液,作用是除去CO2气体中混有的HCl气体,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有NaCl NaOH
考点:Na2CO3制备实验
点评:此题考查学生对碳酸钠的熟练程度,特别注意的地方是:整个过程中对实验目的的把握。

(12分)过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,它的制备原理和路线如下(图中BC—1、BC—2均为稳定剂):
2Na2CO3 + 3H2O2 → 2 Na2CO3·3H2O2 △H<0
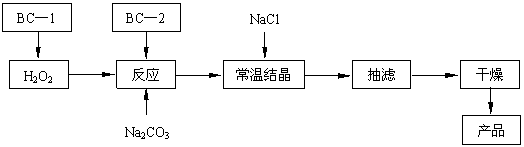 |
回答下列问题:
⑴过碳酸钠用作消毒剂时,其消毒机理与下列 (填写序号) 物质相似。
A.75%酒精 B.苯酚 C. KMnO4稀溶液 D.84 消毒液(NaClO溶液)
⑵结晶过程中加入氯化钠搅拌的作用是 。
⑶加入BC—2稳定剂与工业纯碱中含有的Fe3+杂质生成稳定的配合物的目的是 。
⑷由实验测定反应温度对产物的影响如下表:
| T/°C | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
根据上表数据,你认为反应最佳的温度选择的范围是 。
⑸以上生产流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是 。
⑹过碳酸钠极易分解,则产生6.72LO2(标况)需过碳酸钠 g。