题目内容
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g) △H>0,在一定条件下,向体积为1L的密闭容器中充入1 mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是

- A.达平衡时,CH4( g)的转化率为75%
- B.0~10 min 内,v(CO)=0.075 mol?L-1·min-1
- C.该反应的化学平衡常数K=0.1875 mol?L-1
- D.当CH4(g)的消耗速率与H2O(g)的生成速率相等,反应到达平衡
D
试题分析:根据图像可知,反应进行到10min时达到平衡状态,氢气和水蒸气的平衡浓度均是0.75mol/L,因此消耗水蒸气的浓度是1mol/L-0.75mol/L=0.25mol/L,则:
CH4(g) +H2O(g)=CO(g) +3H2(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) 0.25 0.25 0.25 0.75
平衡浓度(mol/L) 0.75 0.75 0.25 0.75
所以达平衡时,CH4(g)的转化率为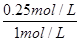 ×100%=25%,A不正确;
×100%=25%,A不正确;
0~10 min 内,v(CO)=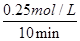 =0.025 mol?L-1·min-1,B不正确;
=0.025 mol?L-1·min-1,B不正确;
该反应的化学平衡常数K=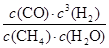 =
= =0.1875 mol2?L-2,C不正确;
=0.1875 mol2?L-2,C不正确;
CH4(g)的消耗速率与H2O(g)的生成速率方向相反,因此当二者相等时,反应达到平衡状态,D正确,答案选D。
考点:考查可逆反应反应速率、转化率和平衡常数的计算以及平衡状态的判断
试题分析:根据图像可知,反应进行到10min时达到平衡状态,氢气和水蒸气的平衡浓度均是0.75mol/L,因此消耗水蒸气的浓度是1mol/L-0.75mol/L=0.25mol/L,则:
CH4(g) +H2O(g)=CO(g) +3H2(g)
起始浓度(mol/L) 1 1 0 0
转化浓度(mol/L) 0.25 0.25 0.25 0.75
平衡浓度(mol/L) 0.75 0.75 0.25 0.75
所以达平衡时,CH4(g)的转化率为
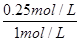 ×100%=25%,A不正确;
×100%=25%,A不正确;0~10 min 内,v(CO)=
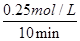 =0.025 mol?L-1·min-1,B不正确;
=0.025 mol?L-1·min-1,B不正确;该反应的化学平衡常数K=
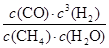 =
= =0.1875 mol2?L-2,C不正确;
=0.1875 mol2?L-2,C不正确;CH4(g)的消耗速率与H2O(g)的生成速率方向相反,因此当二者相等时,反应达到平衡状态,D正确,答案选D。
考点:考查可逆反应反应速率、转化率和平衡常数的计算以及平衡状态的判断

练习册系列答案
相关题目
下图为元素周期表的局部,A、B、C、D为周期表中短周期元素,已知A原子最外电子层上的电子数是其次外层的一半。据此判断下列正确的是
| B | D | ||
| A | C |
- A.A位于第2周期1A族
- B.B的最高价氧化物的水化物是弱酸
- C.原子半径A>C>B>D
- D.气态氢化物的热稳定性B>D>C>A