题目内容
【题目】绿矾(FeSO47H2O)在医药和染料生产中有广泛应用。下面是以铁屑(含少量锡等杂质)生产绿矾的一种方法:
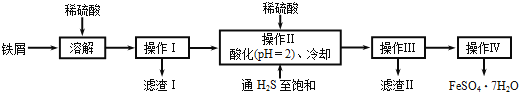
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是__;通入硫化氢至饱和的目的是:①除去操作I所得溶液中含有的Sn2+等杂质离子;②___。
(2)操作Ⅳ的顺序依次为:___、冷却结晶、___。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②___。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.0100molL-1KMnO4溶液滴定至终点,消耗KMnO4,溶液体积的平均值为20.00mL。(滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)则上述样品中FeSO47H2O的质量分数为___。
【答案】使Sn2+完全变成SnS沉淀,而Fe2+不沉淀 防止Fe2+的氧化 蒸发浓缩 过滤洗涤 降低洗涤过程中FeSO47H2O的损耗 97.54%
【解析】
根据流程图可知,铁屑加入稀硫酸溶解过滤得到不溶性杂质,滤液用硫酸酸化后调节pH为2,使锡离子完全沉淀,此时Fe2+不沉淀,通入H2S至饱和除去操作I中含有的Sn2+等杂质离子,H2S具有较强的还原性,能防止Fe2+被氧化,过滤可得滤渣Ⅱ为SnS,通过蒸发浓缩,洗涤得到结晶;
(1)根据已知条件可知,在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,操作Ⅱ加入稀硫酸调节pH为2是为了除去杂质Sn2+,通入H2S至饱和,H2S具有较强的还原性,能防止Fe2+被氧化;
(2)操作Ⅳ的目的是从滤液中析出绿矾,利用蒸发浓缩、冷却结晶、洗涤过滤可得晶体;
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,可除去表面的杂质,温度降低,溶解度降低,可减少晶体的损失;
(4)根据滴定实验的反应终点发生的反应进行计算。
(1)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中通入硫化氢至饱和并用硫酸酸化至pH=2的目的是,在溶液PH=2时使Sn2+完全沉淀,而亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化;
(2)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,冷却结晶析出后过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、冷却结晶、过滤洗涤;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失;
(4)a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL;依据反应方程式进行计算:
5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O
5 1
n(Fe2+) 0.01000mol/L×0.0200L
计算得到;n(Fe2+)=0.001mol;则250mL溶液中含Fe2+=0.001mol×![]() =0.01mol;FeSO47H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;质量分数=
=0.01mol;FeSO47H2O物质的量为0.01mol,质量=0.01mol×278g/mol=2.78g;质量分数=![]() ×100%=97.54%。
×100%=97.54%。

 阅读快车系列答案
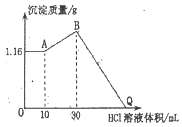
阅读快车系列答案【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2(g)的平衡转化率如表所示。
甲 | 乙 | 丙 | 丁 | ||
密闭容器体积/L | 2 | 2 | 2 | 1 | |
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是
A.甲中反应的平衡常数小于乙
B.SO2的平衡转化率:α1>α2=α3
C.容器中SO3的物质的量浓度:丙>甲=丁
D.该温度下,甲和乙中反应的平衡常数K均为400