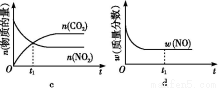
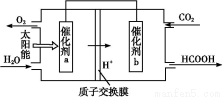
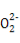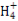题目内容
将铁铝矾[Al2Fe(SO4)4·xH2O]溶于水中,得到浅绿色溶液,有关该溶液的叙述正确的是( )
A.铁铝矾有净水作用,其水溶液显中性
B.该溶液中:2c(Al3+)+c(Fe2+)+c(H+)=4c(S )+c(OH-)
)+c(OH-)
C.在空气中,该溶液蒸干并灼烧,最后所得的残留固体为Al2O3、Fe2O3
D.向该溶液中加入Ba(OH)2溶液,当S 完全沉淀时,Al3+、Fe2+恰好被完全沉淀
完全沉淀时,Al3+、Fe2+恰好被完全沉淀
D
【解析】根据正负化合价代数和为0知,铁铝矾中含Al3+、Fe2+,它们水解使溶液呈酸性,A项错误;根据电荷守恒,在Al2Fe(SO4)4溶液中3c(Al3+)+2c(Fe2+)+c(H+)=2c(S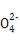 )+c(OH-),B项错误;C项中因水解生成的H2SO4不挥发,故蒸干并灼烧该溶液,最后所得的残留固体为Fe2(SO4)3和Fe2O3与Al2(SO4)3的混合物,C项错误;当S
)+c(OH-),B项错误;C项中因水解生成的H2SO4不挥发,故蒸干并灼烧该溶液,最后所得的残留固体为Fe2(SO4)3和Fe2O3与Al2(SO4)3的混合物,C项错误;当S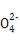 完全沉淀时发生反应:Al2Fe(SO4)4+4Ba(OH)2
完全沉淀时发生反应:Al2Fe(SO4)4+4Ba(OH)2 2Al(OH)3↓+Fe(OH)2↓+4BaSO4↓,D项正确。
2Al(OH)3↓+Fe(OH)2↓+4BaSO4↓,D项正确。

 名校课堂系列答案
名校课堂系列答案已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
B.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
D.在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)