题目内容
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
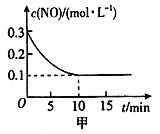
(l)T℃时,将0.6mol NO和0.2 mol O3气体充入到2L固定容积的恒温密闭容器中,NO的浓度随反应时间的变化如图甲所示。
①T℃时,反应3NO(g)+O3(g) ![]() 3NO2(g)的平衡常数K=________.
3NO2(g)的平衡常数K=________.
②不能说明反应达到平衡状态的是_________(填序号).
A.气体颜色不再改变
B.气体的平均摩尔质量不再改变
C.气体的密度不再改变
D.单位时间内生成O3和NO2物质的量之比为1:3
(2)已知2NO2![]() N2O4,如图乙所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊,关闭K2,各将1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为
N2O4,如图乙所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊,关闭K2,各将1molNO2通过K1、K3分别充入真空A、B中,反应起始时A、B的体积相同均为![]() L(忽略导管中的气体体积).
L(忽略导管中的气体体积).
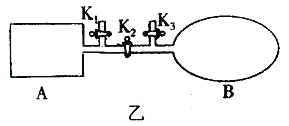
①若容器A中到达平衡所需时间![]() s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率
s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率![]() _____________________.
_____________________.
②若打开K2,平衡后B容器的体积缩至0.4![]() L,则打开K2之前,气球B体积为_________L.
L,则打开K2之前,气球B体积为_________L.
③若平衡后在A容器中再充入0.5molN2O4,则重新到达平衡后,平衡混合气中NO2的体积分数___________(填“变大”“变小”或“不变”)。
【答案】 240 C ![]() 0.7a 变小
0.7a 变小
【解析】试题分析:(l)根据“三段式”计算反应3NO(g)+O3(g) ![]() 3NO2(g)的平衡常数K。
3NO2(g)的平衡常数K。
②根据平衡状态标志判断。
(2)①根据![]() 计算化学反应速率
计算化学反应速率![]() 。
。
②打开K2前和打开K2之后,是等温等压条件下的等效平衡。
③若平衡后在A容器中再充入0.5molN2O4,体积不变,相当于加压。
解析:(l)根据“三段式”

![]()
②A.气体颜色不再改变,说明二氧化氮浓度不变,一定达到平衡状态;
B.根据![]() ,气体质量不变、物质的量变小,气体的平均摩尔质量是变量,平均摩尔质量不再改变,一定平衡;
,气体质量不变、物质的量变小,气体的平均摩尔质量是变量,平均摩尔质量不再改变,一定平衡;
C.根据![]() ,气体质量不变、容器气体不变,密度是恒量,气体的密度不再改变不一定平衡;D.单位时间内生成O3和NO2物质的量之比为1:3,说明正逆反应速率相等,一定平衡;故选C。
,气体质量不变、容器气体不变,密度是恒量,气体的密度不再改变不一定平衡;D.单位时间内生成O3和NO2物质的量之比为1:3,说明正逆反应速率相等,一定平衡;故选C。
(2)设达到平衡生成N2O4 xmol
①
![]() x=0.2
x=0.2
![]()
![]()
![]() 。
。
②打开K2前和打开K2之后,是等温等压条件下的等效平衡,由于此时反应物的量是B中的2倍,则打开K2之前,气球B体积为![]() =0.7a L.
=0.7a L.
③若平衡后在A容器中再充入0.5molN2O4,体积不变,相当于加压,则重新到达平衡后,平衡混合气中NO2的体积分数变小。

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案