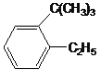
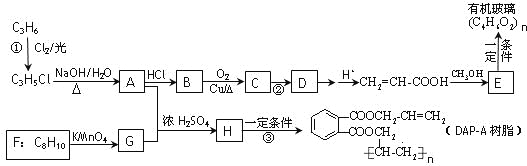
题目内容
【题目】溴化亚铜(CuBr)微溶于水,不溶于乙醇,可用作有机合成中的催化剂。实验室中可利用无水硫酸铜、溴化钠为主要原料制备溴化亚铜,制备流程如下:

回答下列问题:
(1)过程①用到的玻璃仪器有烧杯、______,其中无水![]() 能否用蓝矾代替?做出判断,并说明理由:________。
能否用蓝矾代替?做出判断,并说明理由:________。
(2)制备CuBr的反应在装置乙中进行,向其中加入32gCuSO4和23g NaBr配制成的150mL水溶液,然后通入足量的SO2(部分夹持及加热装置已略去)。

①装置甲中,不能采用浓度为98%的浓硫酸,一般采用浓度为70%左右的浓硫酸,其原因是________。
②写出装置乙中发生反应的离子方程式:_____,该反应需保持反应液在60℃,最佳加热方式为______,该装置中应用搅拌器搅拌的目的是______,Cu2+、Br-反应完毕的标志是______________。
③丙中倒扣的漏斗可防止液体倒吸,下列装置中不能防止液体倒吸的是________(填标号)。
a. b.
b. c.
c. d.
d.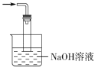
(3)洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,其目的是_____________。
(4)最后经洗涤、干燥得到21.6g产品,则该实验的产率是________。
【答案】玻璃棒 能,因![]() 需配制成水溶液 因反应的实质是
需配制成水溶液 因反应的实质是![]() 与
与![]() 的反应,而98%硫酸中主要以
的反应,而98%硫酸中主要以![]() 分子形式存在,
分子形式存在,![]() 无法电离出
无法电离出![]() ,硫酸浓度过低时,不利于
,硫酸浓度过低时,不利于![]() 逸出
逸出  水浴加热 加快反应速率 溶液的蓝色褪去 a 防止CuBr被氧化 75%(或0.75)
水浴加热 加快反应速率 溶液的蓝色褪去 a 防止CuBr被氧化 75%(或0.75)
【解析】
在CuSO4和NaBr的固体混合物,加水溶解所得混合溶液中通入SO2气体,即可得到CuBr沉淀,经过滤洗涤干燥获得产品;由于溴化亚铜易被氧化,可以使用二氧化硫的水溶液进行洗涤,防止溴化亚铜被氧化;实验室制取二氧化硫可用亚硫酸钠固体与70%的硫酸反应,二氧化硫气体有毒,尾气需要吸收处理,但要注意防倒吸;实际产生的CuBr的质量与通过化学反应计算出的理论上得到的CuBr质量之间的比值,即为产率。
(1) 过程①中固体溶解需要在烧杯中进行,且需要使用玻璃棒搅拌加快溶解;硫酸铜配制成溶液需要加水溶解,则无水CuSO4可用蓝矾代替;
(2) ①利用Na2SO3固体与浓硫酸反应的实质是SO32-+2H+=SO2↑+H2O,而98%硫酸中主要以H2SO4分子形式存在,Na2SO3无法电离出SO32-;硫酸浓度过低时,二氧化硫在水中溶解的较多,不利于![]() 逸出,故不用浓度为98%的浓硫酸,而选择浓度为70%左右的浓硫酸;
逸出,故不用浓度为98%的浓硫酸,而选择浓度为70%左右的浓硫酸;
②装置乙中CuSO4和NaBr的混合溶液中通入SO2气体,生成CuBr沉淀,发生反应的离子方程式为2Cu2++2Br-+ SO2+2H2O=SO42-+2CuBr↓+4H+;该反应需保持反应液在60℃,则选择水浴加热;该装置中应用搅拌器搅拌的目的是增大反应物接触面积,加快反应速率;当溶液的蓝色褪去,即说明Cu2+、Br-反应完毕;
③a.多孔球泡可增大气体与溶液的接触面积,但无法防倒吸,故a错误;
b.气体不溶于CCl4,可防倒吸,故b正确;
c.当产生倒吸现象时,少量液体进入球形干燥管内,烧杯中液体回落,吸收液受自身重量的作用又流回烧杯内,可防倒吸,故c正确;
d.当产生倒吸现象时,少量液体进入玻璃管内,烧杯中液体回落,吸收液受自身重量的作用又流回烧杯内,可防倒吸,故d正确;
故答案为a;
(3) 溴化亚铜微溶于水,且易被空气中氧气氧化,则洗涤CuBr沉淀时采用SO2的水溶液而不采用蒸馏水,可防止CuBr被氧化,且减少产品的流失。
(4) 32gCuSO4的物质的量为![]() =0.2mol,23g NaBr的物质的量为
=0.2mol,23g NaBr的物质的量为![]() =0.22mol,则理论生成的CuBr的物质的量为0.2mol,则该实验的产率是
=0.22mol,则理论生成的CuBr的物质的量为0.2mol,则该实验的产率是![]() =75%。
=75%。

【题目】现代污水处理工艺中常利用聚合铁在水体中形成絮状物,以吸附![]() 等重金属离子,聚合铁简称PFS,化学式为
等重金属离子,聚合铁简称PFS,化学式为![]() 。下列说法错误的是
。下列说法错误的是
元素 | Mn | Fe | |
电离能/kJ·mol-1 |
| 717 | 762 |
| 1509 | 1561 | |
| 3248 | 2957 | |
A.PFS中铁元素显+3价
B.基态铁原子的价电子排布式为![]()
C.由![]() 溶液制备PFS需经过氧化、水解和聚合等过程
溶液制备PFS需经过氧化、水解和聚合等过程
D.由表可知再失去一个电子时,气态![]() 比气态
比气态![]() 难
难