题目内容
3.25℃时,0.05mol/L的Ba(OH)2溶液,pH为( )| A. | 12.7 | B. | 12.0 | C. | 13.0 | D. | 13.7 |
分析 先计算出溶液中氢氧根离子的浓度,再根据Kw=c(OH-).c(H+)计算Ba(OH)2溶液中C(H+),最后根据pH=-lgc(H+)计算出溶液的pH.
解答 解:0.05mol/L的Ba(OH)2溶液溶液中氢氧根离子浓度为0.1mol/L,Kw=c(OH-).c(H+)=1.0×10-14,c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13mol/L,pH=-lgc(H+)=13,
故选C.
点评 本题考查了溶液的pH的简单计算,题目难度不大,注意掌握溶液pH的计算表达式,能够根据酸碱溶液的浓度计算溶液的pH.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.粒子甲在溶液中的转化关系如图所示,粒子甲不可能是( )

| A. | NH4 + | B. | Al(OH)3 | C. | S | D. | Al |
14.X(盐)和Y(酸)反应,可放出有气味的气体Z,Z跟过量NaOH反应又得到X,Z氧化的最终产物为W气,W气溶于水又得到Y,则X和Y是( )
①Na2S和稀H2SO4 ②Na2SO3和盐酸 ③Na2S和盐酸 ④Na2SO3和稀H2SO4.
①Na2S和稀H2SO4 ②Na2SO3和盐酸 ③Na2S和盐酸 ④Na2SO3和稀H2SO4.
| A. | 只有① | B. | ①② | C. | ②③ | D. | ①④ |
18.为了研究影响化学反应速率的因素,甲、乙、丙、丁四位学生分别设计了如下四个实验,你认为不 正确的是( )
| A. | 100 mL 2 mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| B. | 将相同大小、形状的铝条与稀硫酸和浓硫酸反应时,稀硫酸产生氢气快 | |
| C. | 将氢气和氯气的混合气体分别放在冷暗处和强光照射下,会发现光照下有氯化氢生成 | |
| D. | 两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管再加入少量二氧化锰,产生氧气的快慢不同 |
8.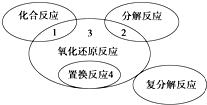 氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
 氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )| A. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | B. | 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | ||
| C. | CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 | D. | Zn+H2SO4═ZnSO4+H2↑ |
12.下列物质中,属于纯净物的是( )
| A. | 石油 | B. | 食醋 | C. | 液态氧 | D. | 水泥砂浆 |
13.一系列物质:NaCl、Cl2、NaClO、Cl2O5、HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
| A. | Na2CO3 C CO2 CO NaHCO3 | |
| B. | Na2S S SO2 Na2SO3 Na2SO4 | |
| C. | NH4Cl N2 NaNO2 NO2 HNO3 | |
| D. | P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4 |
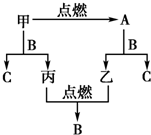 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体.它们之间的转化关系如图所示.