题目内容
【题目】氮、磷及其化合物在科研及生产中均有着重要的应用.
(1)室温下,0.1mol/L的亚硝酸(HNO2)、次氯酸的电离常数分Ka别为:7.1×10-4、2.98×10-8.写出HNO2、HClO、NaNO2、NaClO四种物质之间发生的复分解反应的离子方程式________。
(2)羟胺(NH2OH)可看成是氨分子内的1个氢原子被羟基取代的产物,常用作还原剂,其水溶液显弱碱性。已知NH2OH在水溶液中呈弱碱性的原理与NH3在水溶液中相似,请用电离方程式表示其原因________________。
(3)亚硝酸钠与氯化钠都是白色粉末,且都有咸味,但亚硝酸盐都有毒性,通常它们可以通过加入热的白醋鉴别,亚硝酸钠遇到白醋会产生一种红棕色刺激性气味气体和一种无色气体,其中的无色气体遇到空气会呈红棕色,该反应的离子方程式为_________。
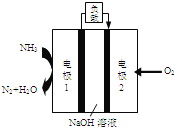
(4)某液氨一液氧燃料电池示意图如下,该燃料电池的工作效率为50%,现用作电源电解500ml的饱和NaCl溶液,电解结束后,所得溶液中NaOH的浓度为0.3mol/L,则该过程中消耗氨气的质量为________(假设溶液电解前后体积不变)。
【答案】HNO2+ClO- =NO2-+HClO NH2OH+H2O![]() NH3OH++OH- 2NO2-+2CH3COOH=NO2+NO+2CH3COO-+ H2O 1.7g
NH3OH++OH- 2NO2-+2CH3COOH=NO2+NO+2CH3COO-+ H2O 1.7g
【解析】
(1)亚硝酸属于弱酸,其水溶液加水稀释,促进亚硝酸的电离,但溶液体积增大,c(H+)减小;同种物质的电离平衡常数只与温度有关,温度不变,![]() 值不变;根据亚硝酸和次氯酸的电离常数
值不变;根据亚硝酸和次氯酸的电离常数![]() 可知:亚硝酸酸性强于次氯酸,根据强酸制弱酸可知离子方程式为:HNO2+ClO- =NO2-+HClO 。
可知:亚硝酸酸性强于次氯酸,根据强酸制弱酸可知离子方程式为:HNO2+ClO- =NO2-+HClO 。
(2)NH3在水溶液中显碱性是因为氨分子结合水中的氢,电离出氢氧根,使得溶液显碱性,所以NH2OH在水溶液中呈弱碱性,是因为NH2OH分子结合水中的氢,电离出氢氧根,用电离方程式表示为NH2OH+H2O![]() NH3OH++OH-。
NH3OH++OH-。
(3)红棕色刺激性气味气体为NO2,根据化合价升降守恒可知另一刺激性气体为NO,醋酸是弱酸,所以离子方程式为2NO2-+2CH3COOH=NO2+NO+2CH3COO-+ H2O。
(4)根据电池示意图可知电极1发生的电极反应式为![]() 。电解NaCl溶液的方程式为:
。电解NaCl溶液的方程式为:![]() ,溶液中NaOH的浓度为
,溶液中NaOH的浓度为![]() ,溶液体积为0.5L,则生成的n(NaOH)=0.15mol,转移电子的物质的量为0.15mol,因为燃料电池的工作效率为50%,则燃料电池中转移电子的物质的量为
,溶液体积为0.5L,则生成的n(NaOH)=0.15mol,转移电子的物质的量为0.15mol,因为燃料电池的工作效率为50%,则燃料电池中转移电子的物质的量为![]() ,根据氨气侧的电极反应式可知消耗氨气的物质的量为0.1mol,质量为1.7g。
,根据氨气侧的电极反应式可知消耗氨气的物质的量为0.1mol,质量为1.7g。

【题目】对于易燃、易爆、有毒的 化学物质,往往会在其包装上贴上危险警告标签.下面所 列的物质中,标签贴错了的是
选项 | A | B | C | D |
物质的化学式 | 氢氧化钠 | 金属汞 | 四氯化碳 | 烟花爆竹 |
危险警告标签 |
|
|
|
|
A. A B. B C. C D. D