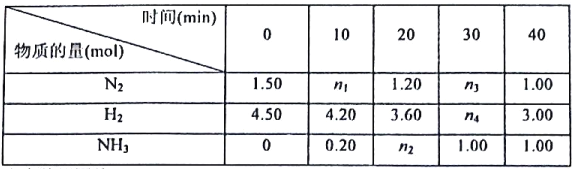
题目内容
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。若向1L1mol·L-1的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,则上述过程中放出的热量等于57.3kJ的是( )
A.①B.②C.③D.①②③
【答案】C
【解析】
25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,因醋酸是弱酸,电离过程需要吸热,所以反应放出的热小于57.3kJ,浓硫酸的溶解放热,所以反应放出的热大于57.3kJ;只有稀硝酸与1mol氢氧化钠反应放出的热量为57.3kJ,故选C。

练习册系列答案
相关题目