��Ŀ����
����Ŀ��һ���¶��£����ݻ�ΪVL���ܱ���������з�Ӧ��aN��g��bM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ�� 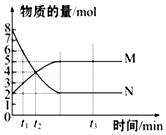
��1���˷�Ӧ�Ļ�ѧ����ʽ��a��b=
��2��t1��t2ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ
��3��t1ʱN��ת����Ϊ��
��4�����Т١����˵���п���֤�� H2��g��+I2��g��2HI��g���Ѵ�ƽ��״̬���ǣ� �ٵ�λʱ��������n molH2 ��ͬʱ����n mol HI
��һ��H��H �����ѵ�ͬʱ������H��I������
������������w��HI��=w��I2��
��������HI��g����H2 ��g����I2 ��g������
��c��HI����c��H2����c��I2��=2��1��1
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ����һ��ʱ��HI��g��Ũ�Ȳ��ٱ仯
���¶Ⱥ�ѹǿһ��ʱ����������ƽ��Ħ���������ٱ仯
���¶Ⱥ�ѹǿһ��ʱ������������ɫ���ٷ����仯
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯��
���𰸡�
��1��2��1
��2��![]() mol/��L��min��
mol/��L��min��
��3��25%
��4���ڡ��ߡ���
���������⣺��1������ͼ��֪����Ӧ�ﵽƽ��״̬ʱ����n��N��=��8��2��mol=6mol����n��M��=��5��2��mol=3mol����ͬʱ���ڲ�ͬ���ʵ����ʵ����仯��֮�ȵ����������֮�ȣ�����N��M�ļ�����֮��=6mol��3mol=2��1�� ���Դ��ǣ�2��1����2��t1��t2ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����= ![]() =
= ![]() mol/��L��min��=
mol/��L��min��= ![]() mol/��L��min����
mol/��L��min����
���Դ��ǣ� ![]() mol/��L��min������3��t1ʱN��ת����=
mol/��L��min������3��t1ʱN��ת����= ![]() ��100%=25%��
��100%=25%��
���Դ��ǣ�25%����4���ٵ�λʱ��������n molH2 ��ͬʱ����n mol HI��ͬʱ��������0.5nmol���������淴Ӧ���ʲ���ȣ���Ӧû�дﵽƽ��״̬���ʴ���
��һ��H��H �����ѵ�ͬʱ������H��I�����ѣ�ͬʱ����һ��H��H�������淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��������������w��HI��=w��I2�����÷�Ӧ���ܴﵽƽ��״̬��Ҳ����û�дﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ��ʴ���������HI��g����H2 ��g����I2 ��g������ʱ�÷�Ӧ��һ���ﵽƽ��״̬���ʴ���c��HI����c��H2����c��I2��=2��1��1���÷�Ӧ���ܴﵽƽ��״̬��Ҳ����û�дﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ��ʴ����¶Ⱥ����һ��ʱ��������ѹǿʼ�ղ��䣬���ܾݴ��ж�ƽ��״̬���ʴ����¶Ⱥ����һ��ʱ��HI��g��Ũ�Ȳ��ٱ仯�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ�����¶Ⱥ�ѹǿһ��ʱ����������ƽ��Ħ������ʼ�ղ��䣬���ܾݴ��ж�ƽ��״̬���ʴ����¶Ⱥ�ѹǿһ��ʱ������������ɫ���ٷ����仯�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ�����¶Ⱥ�ѹǿһ��ʱ������������������ʵ��������ȣ���Ӧǰ�����������ʵ������䣬��������������䣬���ܶ�ʼ�ղ��䣬���ܾݴ��ж�ƽ��״̬���ʴ���
��ѡ���ڡ��ߡ��ᣮ

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�