��Ŀ����
����Ŀ����ѧС��������ͼװ�ý���ijЩ������Ʊ�������ʵ�飬ͼ�мг�װ����ʡ�� 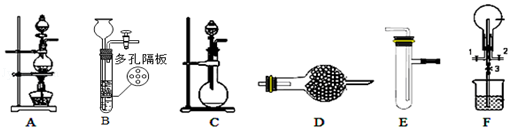
��1��Ϊ��ȡ���ﰱ�����ɽ�װ��C��װ��D���ӣ���װ��D�еĹ����ѡ�� �� a����ʯ��b����ˮ�Ȼ��� c������������d����ʯ��
��2��װ��F������̽�������Ͱ�����Ӧ��ʵ��ʱ����1��3���ر�2��������ƿ��ͨ��һ�����壬Ȼ��ر�1��3����2������ƿ�л���ͨ����һ�����壮ʵ��һ��ʱ�����ƿ�ڳ���Ũ��İ��̺��������ڱ����ᣬ������һ�ֵ������壮д������������������Ӧ�Ļ�ѧ����ʽ �� �����һ��ʵ�鷽�������ù����е������� ��
��3������װ��A��E�������ʵ��Ƚ������Ӻ������ӵĻ�ԭ��ǿ������֤�����۵�ʵ�������� ��
���𰸡�
��1��ad
��2��8NH3+3Cl2=N2+6NH4Cl��ȡ�����������Թ��У���������NaOH��Һ�����ȣ��ڹܿ���ʪ��ĺ�ɫʯ����ֽ������������壬��ʪ��ĺ�ɫʯ����ֽ������֤����������NH4+
��3��װ��E�е�NaBr��Һ��Ⱥ�ɫ
���������⣺��1��Cװ���Dz���Ҫ�����Ʊ�������װ�ã�����Ũ��ˮ������ʯ�Ҳ�������������Ϊ�������壬Ϊ��ȡ���ﰱ�����ɽ�װ��C����Dװ�ø���ܸ���İ�����װ��D�еĸ�����ڹ�����ѡ��ʯ�Һ���ʯ�ң����Դ��ǣ�ad����2��ʵ��ʱ����1��3���ر�2����ƿ��ͨ��������Ȼ��ر�1��3����2������ƿ�л���ͨ��һ�����İ�����ʵ��һ��ʱ�����ƿ�ڳ���Ũ��İ��̲��������ڱ����ᣬ��֪�����백���ɷ�����Ӧ��3Cl2+2NH3=N2+6HCl�����ݷ�Ӧ��ѧ����ʽ�ж������ɵ��Ȼ������������Ӧ���ɵ��Ȼ�泥�����������������Ӧ�Ļ�ѧ����ʽΪ��8NH3+3Cl2=N2+6NH4Cl����Ӧ��笠����ӵļ��鷽���ǣ�ȡ�����������Թ��У���������NaOH��Һ�����ȣ��ڹܿ���ʪ��ĺ�ɫʯ����ֽ������������壬��ʪ��ĺ�ɫʯ����ֽ������֤����������NH4+�����Դ��ǣ�8NH3+3Cl2=N2+6NH4Cl��ȡ�����������Թ��У���������NaOH��Һ�����ȣ��ڹܿ���ʪ��ĺ�ɫʯ����ֽ������������壬��ʪ��ĺ�ɫʯ����ֽ������֤����������NH4+����3������װ��A��E�������ʵ��Ƚ�Cl����Br���Ļ�ԭ��ǿ��������ͨ���廯����Һ�У���������������Ϊ�嵥�ʣ���ӦΪ��Cl2+2NaBr=Br2+2NaCl���嵥������ˮ��Һ�ʳȺ�ɫ�� ���Դ��ǣ�װ��E�е�NaBr��Һ��Ⱥ�ɫ��