题目内容
17.硒(Se)是人体必需的微量元素,在元素周期表中的位置如表,下列关于硒元素的叙述正确的是( )| O | |
| S | |
| Se | Br |
| A. | 硒位于元素周期表第四周期第IVA族 | |
| B. | 硒的非金属性比S弱 | |
| C. | H2Se比HBr稳定 | |
| D. | 最高价氧化物的化学式为SeO2 |
分析 根据Se在周期表中的位置可知,硒与氧、硫同主族,位于元素周期表中的第四周期第ⅥA族,由Br处于同周期,非金属性S<Br,最高正价为+6,处于过渡元素之后,原子序数与S相差Se所在周期容纳元素种数,据此解答.
解答 解:A.根据Se在周期表中的位置可知,硒与氧、硫同主族,位于元素周期表中的第四周期第ⅥA族,故A错误;
B.同主族从上往下非金属性减弱,所以硒的非金属性比S弱,故B正确;
C.非金属性S<Br,HBr比H2Se稳定,故C错误;
D.Se处于ⅥA族,最高正价为+6,最高价氧化物的化学式是SeO3,故D错误;
故选B.
点评 本题考查结构性质位置关系,难度不大,注意整体把握元素周期表的结构与元素周期律的掌握.

练习册系列答案
相关题目
7.某溶液中含有Ag+、Ba2+、Mg2+离子,为了将这三种离子逐个沉淀分离,加入下列离子的先后顺序正确的是( )
| A. | CO32-、Cl-、OH- | B. | Cl-、CO32-、OH- | C. | OH-、Cl-、CO32- | D. | Cl-、OH-、CO32- |
8.下列各组离子在溶液中一定能大量共存的是( )
| A. | 使紫色石蕊变蓝的溶液:K+、Na+、CH3COO-、SO42- | |
| B. | 含有较多CO32-的溶液中:K+、Fe3+、SO42-、NO3- | |
| C. | 水电离产生的氢离子浓度为10-11mol/L:K+、Ca2+、HCO3-、NO3- | |
| D. | 存在较多的AlO2-的溶液中:Mg2+、Ba2+、Br-、HCO3- |
5.某元素一价阴离子的核外有18个电子,质量数为35,该微粒符号可表示为( )
| A. | ${\;}_{18}^{35}$Cl- | B. | ${\;}_{17}^{35}$Cl | C. | ${\;}_{19}^{35}$Cl- | D. | ${\;}_{17}^{35}$Cl- |
12.下列变化过程中△H<0的是( )
| A. | Na与水反应 | B. | HCl分解为H2和Cl2 | ||
| C. | 电解Al2O3得到Al和O2 | D. | Ba(OH)2•8H2O与NH4Cl晶体混合反应 |
9.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中不正确的是( )
| A. | 由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-═Cu2+ | |
| B. | 由Al、Cu、稀硫酸组成原电池,负极反应式为:Al-3e-═Al3+ | |
| C. | 由Al、Mg、NaOH溶液组成原电池,负极反应式为:Al+4OH--3e-═AlO2-+2H2O | |
| D. | 由Al、Cu、浓硝酸组成的原电池中,负极反应式为:Cu-2e-═Cu2+ |
 如图为某原电池装置:
如图为某原电池装置: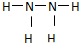 ,过氧化氢的电子式
,过氧化氢的电子式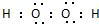 .
.