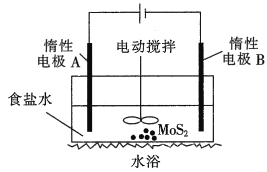
题目内容
【题目】往某溶液中通入过量Cl2无变化,再加入BaCl2溶液和稀盐酸时,产生白色沉淀,该盐可能是( )
A.NaClB.K2SO3C.AgNO3D.Na2CO3
【答案】B
【解析】
氯气通入水中,发生反应Cl2+H2O![]() H++Cl-+HClO。
H++Cl-+HClO。
A、NaCl溶液通入氯气后,加入BaCl2溶液和稀盐酸,溶液中无可沉淀离子,A不符合题意;
B、K2SO3溶液电离出SO32-,通入过量氯气后发生氧化还原反应,产生SO42-;再加入BaCl2溶液和稀盐酸,产生BaSO4白色沉淀,B符合题意;
C、AgNO3溶液中含有Ag+,通入过量氯气后,氯气与水反应生成大量的Cl-,Ag++ Cl-=AgCl↓,产生大量白色沉淀,并非无变化,C不符合题意;
D、Na2CO3溶液中含有CO32-,通入过量氯气后,氯气与水反应生成大量的H+,CO32-+ 2H+=H2O+CO2↑,产生大量气泡,并非无变化,D错误不符合题意;
答案为B。

练习册系列答案
相关题目
【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol