题目内容
【题目】MoS2(s)(辉钼矿的主要成分可用于制取钼的化合物、润滑添加剂、氢化反应和异构化反应的催化剂等,回答下列问题:
(1)已知:MoS2(s)=Mo(s)+S2(g) △H1;
S2(g)+2O2(g)=2SO2(g) △H2;
2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) △H3;;
反应2Mo(s)+3O2(g)=2MoO3(s)的△H=______用含△H1、△H2、△H3的代数式表示
(2)利用电解法可浸取辉钼矿得到Na2MoO4和Na2SO4溶液装置如图所示。
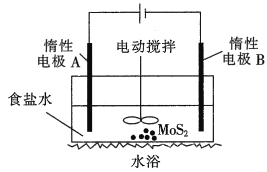
①阴极的电极反应式为__________。
②MoO42-在电极______(填A或B)附近生成。
③实际生产中,惰性电极A一般不选用石墨,而采用DSA惰性阳极(基层为TiO2,涂层为RuO2+IrO2),理由是_______________。
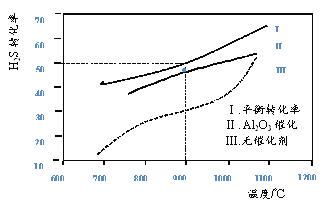
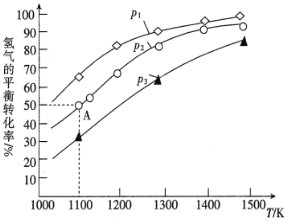
(3)用辉钼矿冶炼Mo的反应为MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。该反应的△H______0(填“>”或“<”);p1、p2、p3按从小到大的顺序为______________。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若充入氦气,平衡 ________(填“向正反应方向”“向逆反应方向”或“不移动”)。
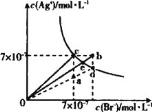
(5)在2L的恒温恒容密闭容器中加入0.1mol MoS2、0.2mol Na2CO3、0.4mol H2,在1100K时发生反应,达到平衡时恰好处于图中A点,则此温度下该反应的平衡常数为______。
【答案】△H3-2△H2-2△H1 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑ A 阳极主要生成Cl2,还会生成O2,生成的O2会消耗石墨 > p1<p2<p3 不移动 2.5×10-3
【解析】
(1)根据盖斯定律,将几个热化学反应方程式叠加,可得到相应反应的热化学反应方程式;
(2)根据电解原理进行分析;
(3)根据化学平衡移动的因素进行分析;
(4)根据化学平衡移动的因素进行分析;
(5)利用三段式进行化学平衡常数的计算;
(1)MoS2(s)=Mo(s)+S2(g) ①,S2(g)+2O2(g)=2SO2(g) ②;2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ③;利用盖斯定律,以及目标反应方程式,得出③-2×②-2×①得出△H=△H3-2△H2-2△H1;答案为△H3-2△H2-2△H1;
(2)①该装置为电解池,电极B连接电源负极,即电极B为阴极,根据电解原理,阴极上应是H2O电离出H+放电,即电极反应式为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;答案为2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑;
②阳极电极反应式为2Cl--2e-=Cl2↑,Cl2具有强氧化性,溶于水后产生的HClO也具有强氧化性,能将MoS2氧化成MoO42-,即MoO42-在阳极A附近生成;答案为A;
③食盐水中含有的阴离子是Cl-、OH-,Cl-失去电子产生Cl2,OH-也可能失去电子变为O2,生成O2会与石墨在高温下反应生成CO2,不断消耗石墨,因此阳极一般不选用石墨,而采用DSA惰性阳极;答案为阳极主要生成Cl2,还会生成O2,生成的O2会消耗石墨;
(3)根据图像,随着温度的升高,H2的转化率增大,根据勒夏特列原理,该反应的正反应方向为吸热反应,即△H>0;在相同的温度下,压强越大,H2的转化率越小,因此根据图像,压强由小到大的顺序是p1<p2<p3;答案为>;p1<p2<p3;
(4)体积固定,达到平衡时,充入氦气,组分的浓度不变,平衡不移动;答案是不移动;
(5)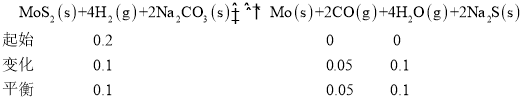
根据化学平衡常数的定义,K=![]() =2.5×10-3;答案为2.5×10-3。
=2.5×10-3;答案为2.5×10-3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案