题目内容
【题目】25C时,氯水中部分含氯的物种的分布分数(平衡时某物种的浓度占各物种浓度之和的百分數) 与pH的关系如下图所示。

下列叙述正确的是
A. 新制的pH=1的氯水中,c(C13-)>c(HClO)>c(H+)
B. 新制氯水中持续通入SO2,pH不断变小,溶液颜色不断加深
C. 25℃时,HClO![]() H++ClO-的电离常数Ka的对数值为lgKa=-7.54
H++ClO-的电离常数Ka的对数值为lgKa=-7.54
D. pH=6的氯水中加入NaOH溶液,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O
【答案】CD
【解析】A、由电荷守恒:c(H+)=c(OH- )+c(C13-),c(H+)>c(C13-),故A错误;B、Cl2+SO2+2H2O=H2SO4+2HCl,pH不断变小,溶液颜色不加深,故B错误;C、25℃时,HClO![]() H++ClO-的电离常数Ka=
H++ClO-的电离常数Ka=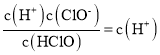 =10-7.54 ,对数值为lgKa=-7.54,故C正确;D、由图增大pH,HClO的浓度变小,是反应物,ClO-增大,是生成物,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O,故D正确;故选CD。
=10-7.54 ,对数值为lgKa=-7.54,故C正确;D、由图增大pH,HClO的浓度变小,是反应物,ClO-增大,是生成物,主要发生的离子反应方程式为HClO+OH-=ClO-+H2O,故D正确;故选CD。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目