��Ŀ����
����Ŀ����1��SO2��O2�Ļ�������У���Ԫ�ص���������Ϊ70%����SO2��O2�����ʵ���֮����__________�����ֻ��������ܶ���ͬ��ͬѹ�������ܶȵ�_____����
��2��ij��̬�����ﻯѧʽΪRO2���ڱ�״������1.28g������������Ϊ448mL����R��Ħ������Ϊ______________.
��3����һ���¶��£���mg��Է�������ΪM�Ŀ��������ܽ���VmLˮ����ˮ���ܶ�Ϊ1g��cm-3����ǡ���γɱ�����Һ���ܶ�Ϊpg.cm-3���������Һ�����ʵ�����������____%�����ʵ����ʵ���Ũ����_________mol��L-1�����¶��´��ε��ܽ���� _____g��
���𰸡� 3�� 4 10/7 32g/mol ![]()
![]()
![]()
��������(1)SO2��O2�Ļ�������У���Ԫ�ص���������Ϊ70%����SԪ�ص���������=1-70%=30%���������������Ϊ100g����SԪ������=100g��30%=30g����SO2������=30g��![]() =60g��������������=100g-60g=40g����SO2�����ʵ���=
=60g��������������=100g-60g=40g����SO2�����ʵ���=![]() =
=![]() mol��O2�����ʵ���=
mol��O2�����ʵ���=![]() =
=![]() mol����SO2��O2�����ʵ���֮��Ϊ
mol����SO2��O2�����ʵ���֮��Ϊ![]() ��
�� ![]() =3��4������ƽ����Է�������=
=3��4������ƽ����Է�������=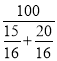 =45.71����ͬ�����£������Ħ������֮�ȵ��������ʵ���֮�ȣ����Ի��������ܶ���ͬ��ͬѹ�������ܶȵı���=
=45.71����ͬ�����£������Ħ������֮�ȵ��������ʵ���֮�ȣ����Ի��������ܶ���ͬ��ͬѹ�������ܶȵı���=![]() =
=![]() ���ʴ�Ϊ��3��4��
���ʴ�Ϊ��3��4�� ![]() ��
��
(2)����£�1.28g������������Ϊ448mL�������ʵ���Ϊ![]() =0.02mol���ʸ��������Ħ������=
=0.02mol���ʸ��������Ħ������=![]() =64g/mol��R�����ԭ������Ϊ64-32=32��Ħ������Ϊ32g/mol���ʴ�Ϊ��32g/mol��
=64g/mol��R�����ԭ������Ϊ64-32=32��Ħ������Ϊ32g/mol���ʴ�Ϊ��32g/mol��
(3)VmLˮ������=VmL��1g/mL=Vg������(����)= ![]() ��100%=
��100%=![]() %����Һ�����ʵ���Ũ��=
%����Һ�����ʵ���Ũ��=![]() =
=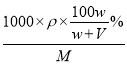 mol/L=
mol/L=![]() mol/L���ÿ������ε��ܽ��=
mol/L���ÿ������ε��ܽ��=![]() ��wg=
��wg=![]() g���ʴ�Ϊ��
g���ʴ�Ϊ�� ![]() ��
�� ![]() ��
�� ![]() ��
��

 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�����Ŀ���ࣨGe���ǵ��͵İ뵼��Ԫ�أ��ڵ��ӡ����ϵ�����Ӧ�ù㷺���ش��������⣺
��1����̬Geԭ�ӵĺ�������Ų�ʽΪ[Ar] �� ����δ�ɶԵ��ӣ�
��2��Ge��C��ͬ��Ԫ�أ�Cԭ��֮������γ�˫������������Geԭ��֮�������γ�˫������������ԭ�ӽṹ�Ƕȷ�����ԭ���� ��
��3���Ƚ�������±������۵�ͷе㣬������仯���ɼ�ԭ��
GeCl4 | GeBr4 | GeI4 | |
�۵�/�� | ��49.5 | 26 | 146 |
�е�/�� | 83.1 | 186 | Լ400 |
��4�������ԭCO2�Ʊ�CH4��Ӧ�У���״����Zn2GeO4�Ǹ÷�Ӧ�����ô�����Zn��Ge��O�縺���ɴ���С��˳���� ��
��5��Ge�������н��ʯ�ͽṹ������Geԭ�ӵ��ӻ���ʽΪ �� ��֮����ڵ��������� ��
��6����������������Ҫ�أ�
��ԭ�������������ʾ�����ڲ���ԭ�ӵ����λ�ã���ͼΪGe�����ľ���������ԭ���������AΪ��0��0��0����BΪ�� ![]() ��0��
��0�� ![]() ����C��
����C�� ![]() ��
�� ![]() ��0������Dԭ�ӵ��������Ϊ ��
��0������Dԭ�ӵ��������Ϊ ��
�ھ������������������Ĵ�С����״����֪Ge�����ľ�������a=565.76pm�����ܶ�Ϊgcm��3���г�����ʽ���ɣ���