题目内容
(2013?莱芜一模)下列说法中,不正确的是( )
分析:A.短周期元素中,He、C、S元素原子最外层电子数是其电子层数两倍;
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C.131I与132I、133I中子数不同,是碘的不同核素,互为同位素;
D.可根据对应最高价含氧酸对应的盐溶液的酸碱性判断酸性的强弱,对应的酸越弱,其酸根离子越易水解.
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C.131I与132I、133I中子数不同,是碘的不同核素,互为同位素;
D.可根据对应最高价含氧酸对应的盐溶液的酸碱性判断酸性的强弱,对应的酸越弱,其酸根离子越易水解.
解答:解:A.短周期元素中,He、C、S元素原子最外层电子数是其电子层数两倍,故A正确;
B.第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+,故B错误;
C.131I与132I、133I中子数不同,是碘的不同核素,互为同位素,故C正确;
D.Na2CO3溶液呈碱性,说明碳酸为弱酸,Na2SO4溶液呈中性,说明硫酸为强酸,非金属性越强,对应最高价氧化物的水化物的酸性越强,故D正确;
故选B.
B.第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+,故B错误;
C.131I与132I、133I中子数不同,是碘的不同核素,互为同位素,故C正确;
D.Na2CO3溶液呈碱性,说明碳酸为弱酸,Na2SO4溶液呈中性,说明硫酸为强酸,非金属性越强,对应最高价氧化物的水化物的酸性越强,故D正确;
故选B.
点评:本题考查结构位置性质关系、同位素、半径比较、盐类水解与非金属性比较、实验方案设计等,难度中等,注意掌握微粒半径比较规律与金属性、非金属强弱的比较.

练习册系列答案
相关题目
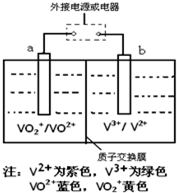 (2013?莱芜一模)某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )
(2013?莱芜一模)某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )