题目内容
下列说法中正确的是 ( )
| A.一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定为1 mol/L |
| B.标准状况下,22.4L的己烷中有20×6.02 × 1023个原子 |
| C.1 mol氯气溶于水转移6.02× 1023个e— |
| D.0.1 mol CH5+含6.02 × lO23个e一 |
D
解析试题分析:A、二氧化氮与四氧化二氮之间存在平衡体系,因此一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定小于1 mol/l,A错误;B、标准状况下己烷不是气态,不能适用于气体摩尔体积,B错误;C、氯气与水反应是可逆反应,则1 mol氯气溶于水转移电子的个数小于6.02× 1023个,C错误;D、CH5+含有电子的数目是6+5-1=10,则0.1 mol CH5+含6.02 × lO23个e一,D正确,答案选D。
考点:考查阿伏伽德罗常数的有关计算

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
| |||||||||||||||
下列有关阿伏伽德罗常数说法正确的是
| A.含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B.标况下,22.4L四氯化碳所含分子数大于NA |
| C.0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D.0.2mol/L的 H2SO4的硫酸溶液与0.1mol/L的 H2SO4的硫酸溶液等质量混合溶液浓度大于0.15mol/L |
NA表示阿伏加德罗常数,下列叙述正确的是 ( )
| A.1 mol Fel2与足量氯气反应时转移的电子数为2NA |
| B.2 L 0.5 mol/l硫酸钾溶液中阴离子所带电荷数为NA |
| C.1 mol Na2O2固体中含离子总数为4 NA |
| D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
设NA为阿伏加德罗常数的值。下列叙述不正确的是( )
| A.7.80g Na2O2与5.85g NaCl所含阴离子数均为0.1NA |
| B.常温常压下,22.4LNH3所含分子数小于NA |
| C.一定条件下,1.4g N2与0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D.标准状况下,28g聚乙烯完全燃烧,产生的CO2数为2NA |
将KCl和KBr混合物13.4g溶于水配成500mL溶液,通入过量Cl2,反应后将溶液蒸干得固体11.175g,则原所配溶液中K+、Cl-、Br-的物质的量浓度之比为:
| A.3:2:1 | B.1:2:3 | C.1:3:2 | D.3:1:1 |
若NA表示阿伏加德罗常数的值,下列说法正确的是
| A.2 .24 L NH3溶干1 L水中得到OH-数约为0.1NA |
| B.l 4 g N2与CO的混合气体含有的原于数目为NA |
| C.25℃时pH=13的NaOH溶液中含有OH-的数目为0 .l NA |
| D.含l mol H2 SO4的浓硫酸与足量铜反应转移的电子为NA |
下列有关化学用语表述正确的是
A.CO2的电子式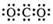 | B.Cl-的结构示意图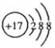 |
| C.次氯酸的结构式 H-Cl-O | D.质量数为37的氯原子 17 37Cl |