题目内容
下列有关阿伏伽德罗常数说法正确的是
| A.含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B.标况下,22.4L四氯化碳所含分子数大于NA |
| C.0.1mol/L 的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D.0.2mol/L的 H2SO4的硫酸溶液与0.1mol/L的 H2SO4的硫酸溶液等质量混合溶液浓度大于0.15mol/L |
B
解析试题分析:A、浓硫酸与锌反应的方程式为Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O,0.2mol硫酸能够生成0.1mol二氧化硫气体,随着反应的进行,浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气,反应的方程式为:Zn+H2SO4=ZnSO4+H2↑,0.2mol硫酸能够失去0.2mol氢气,所以0.2mol锌与浓硫酸充分反应后生成的气体一定大于0.1mol,生成气体的分子数大于0.1NA,故A错误;B.标况下,四氯化碳为液体,摩尔体积小于22.4L/mol,则22.4L四氯化碳的物质的量大于1mol,所含分子数大于NA,故B正确;C.没有告诉硝酸银溶液的体积,无法计算溶液中阳离子带的电荷数目,故C错误;D.设0.2mol/L的H2SO4的硫酸溶液的密度为x,0.1mol/L的H2SO4的硫酸溶液的密度为y,硫酸浓度越大则密度越大,所以x>y,等质量两溶液混合后,设质量为m,则混合液中硫酸的浓度为:
ZnSO4+SO2↑+2H2O,0.2mol硫酸能够生成0.1mol二氧化硫气体,随着反应的进行,浓硫酸变成稀硫酸,锌与稀硫酸反应生成氢气,反应的方程式为:Zn+H2SO4=ZnSO4+H2↑,0.2mol硫酸能够失去0.2mol氢气,所以0.2mol锌与浓硫酸充分反应后生成的气体一定大于0.1mol,生成气体的分子数大于0.1NA,故A错误;B.标况下,四氯化碳为液体,摩尔体积小于22.4L/mol,则22.4L四氯化碳的物质的量大于1mol,所含分子数大于NA,故B正确;C.没有告诉硝酸银溶液的体积,无法计算溶液中阳离子带的电荷数目,故C错误;D.设0.2mol/L的H2SO4的硫酸溶液的密度为x,0.1mol/L的H2SO4的硫酸溶液的密度为y,硫酸浓度越大则密度越大,所以x>y,等质量两溶液混合后,设质量为m,则混合液中硫酸的浓度为: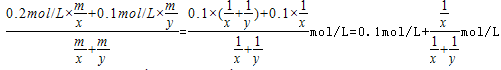 ,
,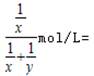
 故D错误;故选B。
故D错误;故选B。
考点:考查阿伏加德罗常数的有关计算和判断

| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
将钠、镁各0.2 m01分别放入100 mL 1 mol/l的盐酸中, 同温同压下产生的气体体积之比是( )
| A.1:2 | B.1:3 | C.2:1 | D.1:l |
下列说法中正确的是 ( )
| A.一定条件下向1 L容器内通入46 g NO2,则NO2的物质的量浓度一定为1 mol/L |
| B.标准状况下,22.4L的己烷中有20×6.02 × 1023个原子 |
| C.1 mol氯气溶于水转移6.02× 1023个e— |
| D.0.1 mol CH5+含6.02 × lO23个e一 |
下列说法不正确的是(NA表示阿佛加德罗常数):
| A.常温常压下,11.2升氯气含有的分子数为0.5NA |
| B.在常温常压下,1mol氮气含有的原子数为2NA |
| C.53g碳酸钠中含NA个Na+ |
| D.标准状况下,以任意比例混和的氢气和氧气混和物22.4升,所含的原子数为2NA |
某盐的混合物中含有0.2 mol/L Na+、0.4 mol/L Mg2+、0.4 mol/L Clˉ,则SO42ˉ为
| A.0.1 mol/L | B.0.2 mol/L | C.0.3 mol/L | D.0.4 mol/L |