题目内容
【题目】下列说法中不正确的是
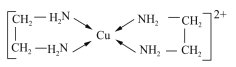
A. 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-) +c(HCO3-)
B. pH相同的盐酸和醋酸,分别用蒸馏水稀释至原体积的m倍和n倍稀释后两溶液pH 相等,则m>n
C. 常温下,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数为10-7
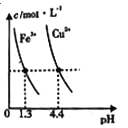
D. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]2]
【答案】B
【解析】A. 电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),故A正确;B. 稀释促进醋酸电离,所以m<n,故B不正确;C.该温度下HA的电离常数为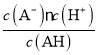 =
=![]() =10-7,故C正确;D. 看图可知:金属阳离子浓度一定,pH:Fe(OH)3<Cu(OH)2,所以Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故D正确。故选B。
=10-7,故C正确;D. 看图可知:金属阳离子浓度一定,pH:Fe(OH)3<Cu(OH)2,所以Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故D正确。故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目