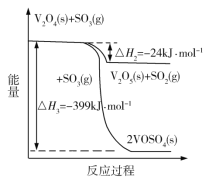
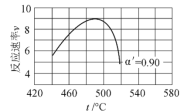
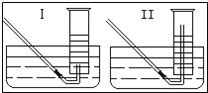
题目内容
【题目】氮氧化物进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾,因此必须对含有氮氧化物的废气进行处理。
(1)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O ①
2NO2+2NaOH=NaNO2+NaNO3+H2O ②
在反应①中,氧化剂是___,还原剂是___。在反应②中,氧化剂是__,还原剂是__。
(2)汽车尾气中含有二氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成氮气和二氧化碳,该反应的化学方程式为___。
(3)氨气亦可用来处理氮氧化物。例如,氨气与二氧化氮发生如下反应:6NO2+8NH3=7N2+12H2O。若某工厂排出的尾气中二氧化氮含量为0.5%(体积分数),处理1×103m3(标准状况)这种尾气,需要多少千克氨气___?
【答案】NO2 NO NO2 NO2 2NO2+4CO![]() 4CO2+N2 5.06
4CO2+N2 5.06
【解析】
(1)NO2+NO+2NaOH═2NaNO2+H2O中,N元素的化合价由+4价降低为+3价,N元素的化合价由+2价升高为+3价;2NO2+2NaOH═NaNO2+NaNO3+H2O中,N元素的化合价由+4价降低为+3价、升高为+5价;
(2)由信息可知,CO和NO反应生成N2和CO2,以此来解答;
(3)尾气中二氧化氮含量为1×106×0.5%=0.5×104L,结合反应的化学方程式计算。
(1)反应①NO2+NO+2NaOH═2NaNO2+H2O中,二氧化氮中N元素的化合价由+4价降低为+3价,一氧化氮中N元素的化合价由+2价升高为+3价,则氧化剂为NO2,还原剂为NO;反应②2NO2+2NaOH═NaNO2+NaNO3+H2O中,二氧化氮中N元素的化合价部分由+4价降低为+3价、部分升高为+5价,所以氧化剂和还原剂均为NO2;
(2)由信息可知,CO和NO2反应生成N2和CO2,反应方程式为2NO2+4CO![]() 4CO2+N2;
4CO2+N2;
(3)尾气中二氧化氮含量为1×106L×0.5%=0.5×104L,则由6NO2 +8NH3═7N2+12H2O可知,设需要氨气的物质的量为![]() ×
×![]() =297.62mol.则氨气的质量为297.62×17×10-3kg=5.06 kg。
=297.62mol.则氨气的质量为297.62×17×10-3kg=5.06 kg。

【题目】X、Y、Z、W为四种常见的短周期元素。其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X | Y | |
Z | W |
请回答以下问题:
(1)W在周期表中位置_____;
(2)X和氢能够构成+1价阳离子,其电子式是_____,Y的气态氢化物比Z的气态氢化物的沸点高,缘故是_____;
(3)X的最高价氧化物的水化物与其氢化物能化合生成M,M的水溶液显酸性的缘故是_____(用离子方程式表示)。
(4)①Y和Z可组成一种气态化合物Q,Q能与W的单质在潮湿环境中反应,反应的化学方程式是_____。
②在一定条件下,化合物Q与Y的单质反应达平衡时有三种气态物质,反应时,每转移4mol电子放热190.0kJ,该反应的热化学方程式是_____。
【题目】甲同学发布了三份无色溶液检测报告,结果如下(水电离的H+、OH-忽略不计):
溶液(1)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cu2+ | 0.2 |
Ba2+ | 0.5 | NO3- | 1.5 |
Mg2+ | 0.3 | Cl- | 0.6 |
溶液(2)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.9 |
Ag+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 |
溶液(3)中所含全部离子及其浓度
离子 | 浓度mol/L | 离子 | 浓度mol/L |
Na+ | 0.1 | Cl- | 0.2 |
K+ | 0.5 | NO3- | 0.3 |
Mg2+ | 0.3 | SO42- | 0.4 |
试分析判断:上述三份检测结果是否可靠,若不可靠,说出理由。
I.溶液(1)结果是否可靠________,理由________。
溶液(2)结果是否可靠_________,理由________。
溶液(3)结果是否可靠_________,理由________。
II.乙同学对可能含有下列6种离子的溶液进行如下实验:Cl-,SO42-,NH4+,CO32-,K+,Na+;
已知:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
a.取200mL上述溶液,向其中加入足量BaCl2溶液,反应后将沉淀过滤,洗涤,干燥,得沉淀4.30g,向沉淀中加入足量的盐酸,有2.33g沉淀不溶。
b.向a的滤液中加入足量的NaOH溶液,加热,产生标况下的气体1.12L(假定气体全部逸出 )
(1)溶液中一定存在的离子有_____,可能存在的离子有_____。
(2)原溶液中![]() ___
___![]() ,
,![]() ___
___![]() (填“>”“<”“=”,下同)
(填“>”“<”“=”,下同)
(3)如果上述6种离子都存在,则![]() ____
____![]() 。
。