题目内容
(14 分)CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标。
(1)250℃时,以镍合金为催化剂,向4 L密闭容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H="-890.3" kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H="2.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H="-566.0" kJ·mol-1
反应CO2(g)+CH4(g)
 2CO(g)+2H2(g) 的△H= ;
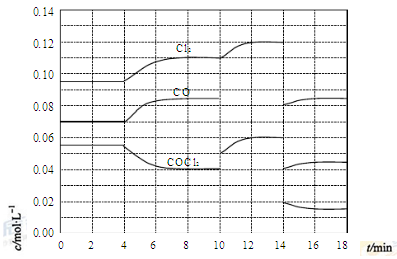
2CO(g)+2H2(g) 的△H= ;③在不同温度下催化剂的催化效率与CO的生成速率如右图所示。t1~t2℃时,温度升高而CO的生成速率降低的原因是 ;
 (?代表CO的生成速率,■代表催化剂的催化效率)
(?代表CO的生成速率,■代表催化剂的催化效率)④为了提高该反应中CH4的转化率,可以采取的措施是 ;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则上述平衡向 (填“正反应”或“逆反应”)方向移动。
(2)以CO2为原料可以合成多种物质。
①可降解二氧化碳聚合物是由CO2加聚而成,写出其结构简式: ;
②以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为 。
(共14分,每空2分)(1)①64 ②+1379.3 kJ·mol-1
(2)①温度超过250℃时,催化剂的催化效率降低 ②(扩体)减小压强或增大CO2的浓度 ③逆反应
(3)①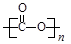 ②CO2+8e-+6H2O=CH4+8OH-
②CO2+8e-+6H2O=CH4+8OH-
解析试题分析:(1)① CO2(g)+CH4(g) 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始(mol) 6 6 0 0
反应(mol) X X 2X 2X
平衡(mol) 6-X 6-X 2X 2X
由CH4的体积分数为0.1,则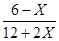 =0.1,解得X=4,所以K=
=0.1,解得X=4,所以K=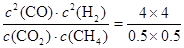 =64;
=64;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ?mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ?mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g) 2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1;
2CO(g)+2H2(g)△H=-890.3kJ?mol-1+2.8kJ?mol-1×2+566.0kJ?mol-1×2=+247.3 kJ?mol-1;
③温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低;
④正反应是体积减小的可逆反应,降低压强、增大CO2的浓度,平衡正向移动,反应物转化率增大;
⑤若再向容器中同时充入2.0 mol CO2、6.0 mol CH4、4.0 molCO 和8.0 molH2,则此时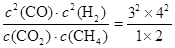 =72>64,所以上述平衡向逆反应方向移动。
=72>64,所以上述平衡向逆反应方向移动。
(2)①CO2的结构式为O=C=O,发生加聚反应得到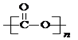 ;
;
②原电池中负极失去电子,正极得到电子,因此CO2在正极发生还原反应转化为甲烷,电极反应为:CO2+8e-+6H2O=CH4+8OH-。
考点:考查化学反应常数、化学平衡以及原电池原理的运用

甲醇燃料分为甲醇汽油和甲醇柴油。工业上合成甲醇的方法很多。
(1)一定条件下发生反应:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1
②2CO(g)+O2(g) =2CO2(g) △H2
③2H2(g)+O2(g)=2H2O(g) △H3
则CO(g) + 2H2(g)  CH3OH(g) △H= 。
CH3OH(g) △H= 。
(2)在容积为2L的密闭容器中进行反应: CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)与反应时间t的变化曲线如图所示。该反应的△H 0(填>、<或=)。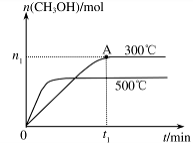
(3)若要提高甲醇的产率,可采取的措施有____________(填字母)。
| A.缩小容器体积 |
| B.降低温度 |
| C.升高温度 |
| D.使用合适的催化剂 |
(4)CH4和H2O在催化剂表面发生反应CH4+H2O
 CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。
CO+3H2,T℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时CH4的转化率为50% ,计算该温度下的平衡常数 (结果保留小数点后两位数字)。(5)以甲醇为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

①B极的电极反应式为 。
②若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移1mole-时,实际上消耗的甲醇的质量比理论上大,可能原因是 。
(6)25℃时,草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。向20ml碳酸钙的饱和溶液中逐滴加入8.0×10-4 mol·L-1的草酸钾溶液20ml,能否产生沉淀 (填“能”或“否”)。
I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
II.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,c2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
(3) 如果2A (g)
 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。  7N2(g)+12H2O(g)+Q(Q>0)。
7N2(g)+12H2O(g)+Q(Q>0)。 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
 SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1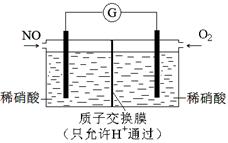
 CO(g)+H2(g);
CO(g)+H2(g); H2(g)+CO2(g)。
H2(g)+CO2(g)。 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。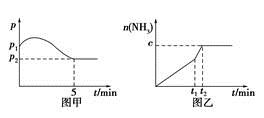
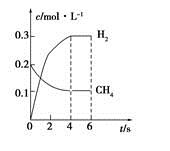
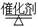 CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。