题目内容
【题目】25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH![]() )>c(Cl-)>c(OH-)
)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:![]() c(Na+)=c(CO
c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
【答案】A
【解析】
A、0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合,溶质为等物质的量的CH3COOH和NaCl,醋酸为弱酸,部分电离,所以c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-),A选项正确;
B、0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合,pH>7,说明一水合氨的电离程度大于铵根离子的水解程度,若不考虑NH4+水解和NH3·H2O的电离,则c(NH4+)= c(NH3·H2O)=c(Cl-),在考虑溶液中水解平衡和电离平衡后,因一水合氨的电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-)>c(NH3·H2O)> c(OH-),B选项错误;
C、根据物料守恒,0.1 mol·L-1Na2CO3溶液中,c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),0.1 mol·L-1 NaHCO3溶液中,c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),二者等体积混合,则2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),即![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C选项错误;
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),C选项错误;
D、0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合,溶质为等物质的量的NaHC2O4和NaCl,根据电荷守恒:c(Na+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-),D选项错误;
故答案为A。

【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
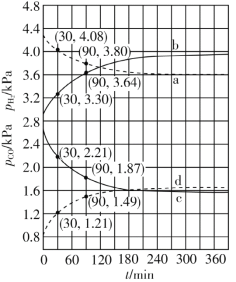
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
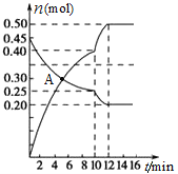
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【题目】某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。
实验方案 | 实验现象 |
①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
②向新制的H2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
③钠与滴有酚酞试液的冷水反应 | C.反应不十分强烈,产生的气体可以在空气中燃烧 |
④镁带与2mol·L-1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
⑤铝条与2mol·L-1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:______________________________________。
(2)实验用品:仪器___________________等;药品________________________等。
(3)实验内容:(*填写题给信息表中的序号)
实验方案* | 实验现象* | 有关化学方程式 |
_______________________________
(4)实验结论:______________________________________。
(5)请从结构理论上简单说明具有上述结论的原因___________________。
(6)请你补充一组实验方案(简单易行),证明此周期中另外两种元素的性质递变规律_____________________________________。