题目内容
14.完成下列实验所选择的装置或仪器不正确的是( )| A | B | C | D | |
| 实 验 | 实验分离水和酒精 | 用铵盐和碱制取氨气 | 用排空气法收集二氧化氮 | 用自来水制取蒸馏水 |
| 装置或仪器 | 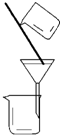 |  | 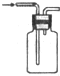 | 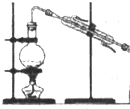 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.水和酒精能透过滤纸;
B.铵盐与碱共热制取氨气,应利用加热装置;
C.二氧化氮密度比空气大;
D.水沸点较低,水中的杂质难挥发.
解答 解:A.水和酒精能透过滤纸,应用蒸馏分离,故A错误;
B.需要把铵盐和碱固体混合物放在大试管中,试管口略向下倾斜固定在铁架台上加热,生成的气体用向下排气法收集,故B正确;
C.二氧化氮密度比空气大,可用向上排空气法收集,故C正确;
D.水沸点较低,水中的杂质难挥发,可用蒸馏制取蒸馏水,故D正确.
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体收集、物质制备及分离与提纯等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
相关题目
4.能证明硅酸的酸性比碳酸的酸性弱的实验事实是( )
| A. | CO2通入可溶性硅酸盐中析出硅酸沉淀 | |
| B. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | 氯化氢通入碳酸钠溶液中放出气体,通入硅酸钠溶液中生成沉淀 |
5.下列关于胶体的叙述不正确的是( )
| A. | 胶体是一种混合物 | |
| B. | 利用丁达尔效应可以区分溶液和胶体 | |
| C. | 胶体是一种介稳体系 | |
| D. | 大小介于1~100 nm 之间的微粒称为胶体 |
2.某同学在实验室进行实验:将一定量蔗糖放入烧杯中,加入少量水搅拌均匀,再加适量 浓硫酸迅速搅拌,产生如下现象:①烧杯立即发热 ②片刻后蔗糖发黄变黑 ③稍后体积 迅速膨胀,产生刺激性气味的气体.下列对该实验的相关说法不正确的是( )
| A. | 现象①-浓硫酸吸水放热 | |
| B. | 现象②-浓硫酸具有脱水性使蔗糖炭化 | |
| C. | 现象③-浓硫酸具有强氧化性,发生反应:C+2H2SO4(浓)CO2↑+2SO2↑+2H2O | |
| D. | 若将③中气体通入澄清石灰水中,出现白色浑浊,可证明气体中存在CO2 |
9.下列反应既属于离子反应,又属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2KClO32KCl+3O2↑ | ||
| C. | Fe+2HCl=FeCl2+H2↑ | D. | 2NaOH+CO2═Na2CO3+H2O |
19.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 5.6g铁与足量稀硫酸反应转移的电子数为0.3NA | |
| B. | 标准状况下,11.2L水中含有分子的数目为0.5NA | |
| C. | 500 mL 0.2 mol•L-1 CaCl2溶液中氯离子数目为 0.1NA | |
| D. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
6.下列各组离子中,能够大量共存且加入稀硫酸会产生气体的是( )
| A. | Fe3+、Na+、HCO、Cl- | B. | Al3+、Na+、Cl-、F- | ||
| C. | Zn2+、K+、Cl-、SO | D. | Fe2+、Na+、Cl-、NO |
12.某有机物X的结构简式如图所示,则下列有关说法中正确的是( )


| A. | X的分子式为C12H14O3 | |
| B. | X在一定条件下能发生加成、加聚、取代、消去等反应 | |
| C. | 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成 | |
| D. | 可用酸性高锰酸钾溶液区分苯和X |
13.下列方程式的书写或描述正确的是( )
| A. | 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-═CaCO3↓+SO42- | |
| B. | 热化学方程式C2H2(g)+O2(g)═2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol | |
| C. | 铂电极电解MgCl2饱和溶液:MgCl2Mg+Cl2↑ | |
| D. | H+(aq)+OH(aq)═H2O(1);△H=-57.3 kJ/mol,表示含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |