题目内容
【题目】(1)有一种可充电电池Na-Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,则该电池在充电时,阳极的电极反应式_________________放电时负极反应的物质是__________________。
(2)如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法正确的是__________
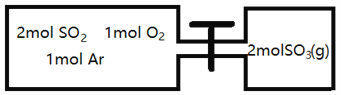
A.第一次平衡时,SO2的物质的量右室更多
B.第一次平衡时,左室内压强一定小于石室
C.第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数大
D.第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小
(3)已知Ksp (Ag2CrO4)=1.0×10-12,向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,则溶液中c(CrO42-)=__________
(4)室温下,0.1mol/LNaHCO3溶液的pH值__________0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)已知:
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
室温下,在0.5mol/LNa2SO3溶液中加入少量水,由水电离出的c(H+) ×c(OH-)__________。(填“变大”、“变小”、“不变”)
【答案】 Na2S+Fe=2Na++FeS+2e- Na BD 1.0×10-8mol/L < 变小
【解析】(1). Na的性质活泼,易失去电子而被氧化,Na为原电池的负极,充电时,阳极发生氧化反应,电极反应式为Na2S+Fe=2Na++FeS+2e-,故答案为:Na2S+Fe=2Na++FeS+2e-;Na;
(2). A. 根据2SO2+O2![]() 2SO3可知,把2molSO3转换成反应物,相当于2molSO2、1molO2,而左室体积大于右室,左室相对于右室相当于减小压强,平衡逆向移动,则第一次平衡时,左室SO2的物质的量更多,故A错误;B. 根据2SO2+O2
2SO3可知,把2molSO3转换成反应物,相当于2molSO2、1molO2,而左室体积大于右室,左室相对于右室相当于减小压强,平衡逆向移动,则第一次平衡时,左室SO2的物质的量更多,故A错误;B. 根据2SO2+O2![]() 2SO3可知,把2molSO3转换成反应物,相当于2molSO2、1molO2,而左室体积大于右室,左室相对于右室相当于减小压强,则第一次平衡时,左室内压强一定小于右室,故B正确;C. 第二次平衡时,容器体积变为右室体积的3倍,把2molSO2、1molO2转换成生成物,相当于2 molSO3,气体物质的量变为右室的2倍,与第一次平衡时相比压强减小,2SO2+O2
2SO3可知,把2molSO3转换成反应物,相当于2molSO2、1molO2,而左室体积大于右室,左室相对于右室相当于减小压强,则第一次平衡时,左室内压强一定小于右室,故B正确;C. 第二次平衡时,容器体积变为右室体积的3倍,把2molSO2、1molO2转换成生成物,相当于2 molSO3,气体物质的量变为右室的2倍,与第一次平衡时相比压强减小,2SO2+O2![]() 2SO3平衡逆向移动,达到第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数小,故C错误;D. 第二次平衡时,容器体积变为左室体积的1.5倍,把2molSO3转换成反应物,相当于2molSO2、1molO2,气体物质的量变为左室的2倍,与第一次平衡时相比压强增大,2SO2+O2
2SO3平衡逆向移动,达到第二次平衡时,SO3的物质的量分数比第一次平衡时右室的SO3的物质的量分数小,故C错误;D. 第二次平衡时,容器体积变为左室体积的1.5倍,把2molSO3转换成反应物,相当于2molSO2、1molO2,气体物质的量变为左室的2倍,与第一次平衡时相比压强增大,2SO2+O2![]() 2SO3平衡正向移动,达到第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小,故D正确;答案为:BD;
2SO3平衡正向移动,达到第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2物质的量的2倍小,故D正确;答案为:BD;
(3). 向0.02mol/L的AgNO3溶液中加入等体积的1. 0×10-4mol/LK2CrO4溶液,发生反应2Ag++CrO42-=Ag2CrO4↓,由反应方程式可知,AgNO3溶液过量,设两溶液的体积均为1L,充分反应后的溶液中银离子浓度为c(Ag+)=![]() ≈0.01mol/L,则反应后的溶液中c(CrO42-)=
≈0.01mol/L,则反应后的溶液中c(CrO42-)=![]() =
=![]() mol/L=1.0×10-8mol/L,故答案为:1.0×10-8mol/L;
mol/L=1.0×10-8mol/L,故答案为:1.0×10-8mol/L;
(4). 室温下,H2SO3的K1=1.54×102、K2=1.02×107,H2CO3的K1=4.3×10-7、K2=5.6×10-11,说明HCO3-水解程度小于SO32水解程度,则0.1mol/LNaHCO3溶液的pH小于0.1mol/LNa2SO3溶液的pH;Na2SO3溶液中存在水解平衡:SO32-+H2O![]() HSO3-+OH-,室温下,在0.5mol/LNa2SO3溶液中加入少量水,促进SO32-的水解,则溶液中由水电离出的n(H+)、n(OH-)都增大,但氢离子、氢氧根离子物质的量增大倍数小于溶液体积增大倍数,c(H+)、c(OH-)减小,二者浓度的乘积减小,故答案为:<;变小。
HSO3-+OH-,室温下,在0.5mol/LNa2SO3溶液中加入少量水,促进SO32-的水解,则溶液中由水电离出的n(H+)、n(OH-)都增大,但氢离子、氢氧根离子物质的量增大倍数小于溶液体积增大倍数,c(H+)、c(OH-)减小,二者浓度的乘积减小,故答案为:<;变小。

【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:______。
(2)联氨(N2H4)是一种还原剂,能与氧气反应生成氮气和水蒸气。试结合下表数据,写出在该反应的热化学方程式:____________________________。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式:__________________________。
(4)常温下用氨水吸收CO2可得利(NH4)2CO3溶液,在(NH4)2CO3溶液中,c(OH-)_________c(H+)(填“>”“<”或“=”);反应NH4++CO32-+H2O![]() NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+HCO3-的平衡常数K=______(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
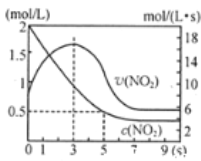
①0~3s时v(NO2)增大的原因是_________。
②5s时NO2转化率为__________。