题目内容
【题目】我们可以通过实验探究来研究化学反应速率的影响因素,
(1)为探讨反应物浓度对化学反应速率的影响,己知:
反应Ⅰ S2O82-+2I-=2SO42-+I2 (慢)反应Ⅱ I2+2S2O32-=2I-+S4O62-(快)
反应 S2O82-+ 2S2O32-= 2SO42-+ S4O62-的反应速率由______________决定(填“反应Ⅰ”、“反应Ⅱ”),I-是此反应的___________________________。
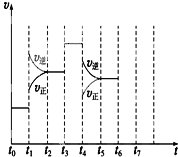
浓度c(S2O82-)反应时间t的变化曲线如下图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)t的变化曲线示意图(进行相应的标注)____________

(2)草酸与高锰酸钾在酸性条件下可以发生化学反应。请补全并配平下面方程式
______H2C2O3+ MnO4-+ =Mn2++CO2+
现有0.00lmol/L的酸性KMnO4溶液和0.0lmol/L的草酸溶液,为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | 温度/℃ | ||
KMnO4 溶液 | 水 | H2C2O4溶液 | ||
① | 4.0 | 0.0 | 2.0 | 25 |
② | 4.0 | 0.0 | 2.0 | 60 |
③ | 4.0 | Vx | 1.0 | 25 |
通过实验①、③可探究草酸的浓度对反应速率的影响,表中Vx=_________mL,理由是_________________。
对比实验①、②的实验现象是___________________________________。
【答案】 反应Ⅰ 催化剂 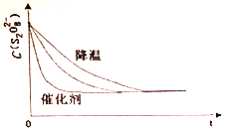 5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O 1.0 保证反应物草酸浓度改变,而其它的不变。 两实验中紫色溶液均褪色,但②褪色更快
5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O 1.0 保证反应物草酸浓度改变,而其它的不变。 两实验中紫色溶液均褪色,但②褪色更快
【解析】(1)反应Ⅰ、S2O82-+2I-=2SO42-+I2 (慢),反应Ⅱ、I2+2S2O32-=2I-+S4O62-(快),反应:S2O82-+ 2S2O32-= 2SO42-+ S4O62-的反应速率由反应Ⅰ决定,根据总反应可知,I-是此反应的催化剂;保持其它条件不变,降低温度,反应速率降低,到达平衡时溶液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达平衡时溶液颜色将由无色变成为蓝色的时间变短,因此图像为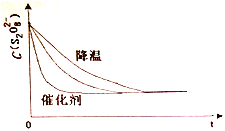 ,故答案为:反应Ⅰ;催化剂;
,故答案为:反应Ⅰ;催化剂;  ;
;
(2)草酸与高锰酸钾在酸性条件下可以发生化学反应生成锰离子、二氧化碳和水,反应的离子方程式为:5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O;根据表格数据,通过实验①、③可探究草酸的浓度对反应速率的影响,需要保证溶液的总体积相同,才能保证反应物草酸浓度改变,而其它的不变,因此表中Vx=1.0mL,实验①的温度比实验②低,反应速率慢,故实验现象为两实验中紫色溶液均褪色,但②褪色更快,故答案为:5 H2C2O4+ 2 MnO4-+ 6H+= 2 Mn2++ 10 CO2+ 8H2O;1.0;保证反应物草酸浓度改变,而其它的不变;两实验中紫色溶液均褪色,但②褪色更快。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案