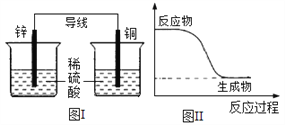
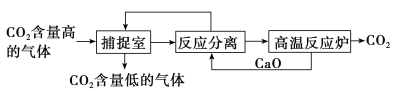
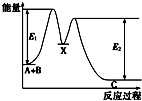
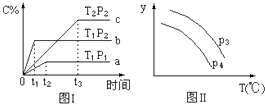
题目内容
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
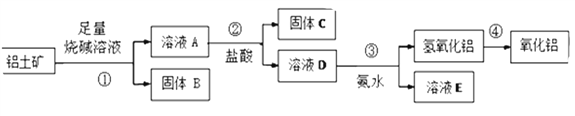
(1)固体B的主要用途有(写出1条即可)__________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:_____________________________________________________________;___________________________________________________________。
(3)第③步中,生成氢氧化铝的离子方程式是____________________________________________________________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是___________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
【答案】 炼铁原料、油漆等 Al2O3+2OH—=2AlO2—+H2O SiO2+2OH—=SiO32—+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al2O3+3Cl2+3C![]() 2AlCl3+3CO 65.4%
2AlCl3+3CO 65.4%
【解析】试题分析:(1)Al2O3、Fe2O3、SiO2中只有氧化铁和氢氧化钠不反应,所以固体B为Fe2O3,主要用途为炼铁、油漆等;(2)Al2O3、Fe2O3、SiO2中Al2O3、SiO2和氢氧化钠反应,方程式分别为:Al2O3+2OH-=2AlO2-+H2O、 SiO2+2OH-= SiO32-+ H2O;(3)溶液D的成分为氯化铝,与氨水反应的方程式为Al3++3NH3·H2O=Al(OH)3↓+ 3NH4+;(4) 每消耗0.5 mol碳单质,转移1 mol电子,说明碳被氧化为一氧化碳,反应方程式为Al2O3+3Cl2+3C![]() 2AlCl3+3CO;(5)根据铝元素守恒,设氧化铝的物质的量为xmol,则生成氢氧化铝的物质的量为2x mol,所以该铝土矿中Al2O3的质量分数是
2AlCl3+3CO;(5)根据铝元素守恒,设氧化铝的物质的量为xmol,则生成氢氧化铝的物质的量为2x mol,所以该铝土矿中Al2O3的质量分数是![]() 。
。

 阅读快车系列答案
阅读快车系列答案