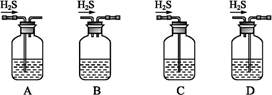
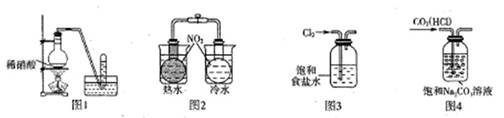
题目内容
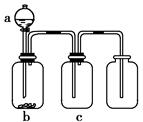
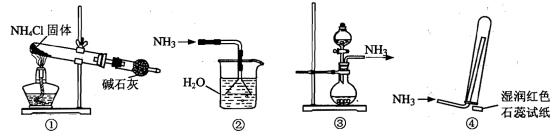
用下图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是

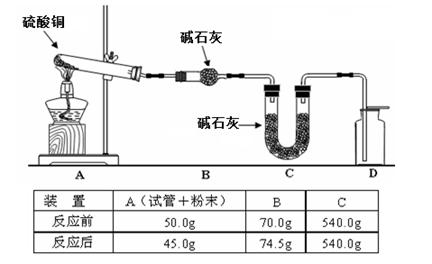
| | 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | 浓硫酸 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀硫酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
A
试题分析:A、制取二氧化氮用浓硝酸和铜反应,可以用浓硫酸干燥,正确;B、二氧化硫气体能与酸性KMnO4溶液反应,不能得到SO2气体,错误;C、制取二氧化碳气体不能用稀硫酸和CaCO3反应,因为生成的CaSO4为微溶物,附着在CaCO3表面阻止反应进行,应该用稀盐酸,错误;D、制取氨气不能用浓硫酸干燥,二者反应生成硫酸铵,错误。

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
 FeSO4+H2↑
FeSO4+H2↑ +5C2
+5C2 +16H+
+16H+