题目内容
【题目】I. 现有下列十种物质:
①液态HCl ②NaHCO3 ③熔融NaCl ④CO2 ⑤蔗糖晶体 ⑥Ba(OH)2溶液 ⑦氢氧化铁胶体 ⑧氨水 ⑨空气 ⑩NaHSO4
(1)上述十种物质中属于电解质的有_______________(填序号)。
(2)⑩在水溶液中的电离方程式为__________________________________。
II.青海昆仑玉被定为十年前北京奥运会奖牌用玉,昆仑玉主要成分是由“透闪石”和“阳起石”组成的纤维状微晶结合体,透闪石(Tremolite)的化学成分为Ca2Mg5Si8O22(OH)2。透闪石的化学式写成氧化物的形式为__________________________。
III.实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为____________ mL。
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶_______________。
②向容量瓶加水定容时眼睛俯视液面_______________。
【答案】①②③⑩ NaHSO4 = Na++H++SO42- 2CaO·5MgO·8SiO2·H2O 27.2 偏高 偏高
【解析】
I、电解质:在水溶液中或熔融状态下能导电的化合物;例:酸、碱、盐,金属氧化物等;非电解质:在水溶液中和熔融状态下不能导电的化合物;例:有机物,非金属氧化物等;单质、混合物不是电解质;硫酸氢钠为强电解质,水溶液中完全电离。
II、硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水(xMOnSiO2mH2O)。注意:①氧化物之间以“”隔开;②系数配置出现的分数应化为整数。如:正长石KAlSi3O8不能改写成K2OAl2O33SiO2,应改写成K2OAl2O36SiO2.③金属氧化物在前(活泼金属氧化物→较活泼金属氧化物),非金属氧化物在后,若同一元素有变价,那么低价在前,高价在后,H2O一般写在最后。
III、(1)根据c=![]() 和稀释定律c(浓)V(浓)=c(稀)V(稀)来计算;
和稀释定律c(浓)V(浓)=c(稀)V(稀)来计算;
(2)根据c=![]() ,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
,通过判断不当操作对溶质的物质的量n和溶液体积V的影响来分析误差。
I、(1)①液态HCl 水溶液能导电,是化合物,属于电解质;
②NaHCO3 熔融状态、水溶液都能导电,属于电解质;
③熔融NaCl能导电,属于电解质;
④CO2 本身不能电离产生自由移动的离子,是非电解质;
⑤蔗糖晶体在水溶液中和熔融状态下不能导电的化合物是非电解质;
⑥Ba(OH)2溶液是混合物,不是电解质;
⑦氢氧化铁胶体是混合物,不是胶体;
⑧氨水是混合物,不是电解质;
⑨空气是混合物,不是电解质;
⑩NaHSO4在水溶液中或熔融状态下能导电的化合物,是电解质;故选:①②③⑩;
(2)硫酸氢钠为强电解质,水溶液中完全电离,电离方程式:NaHSO4 =Na++H++SO42﹣;故答案为:NaHSO4 =Na++H++SO42﹣。
II、硅酸盐改写成氧化物的形式为:活泼金属氧化物较活泼金属氧化物SiO2H2O,同时要遵循原子守恒,Ca2Mg5Si8O22(OH)2中金属活泼性Ca>Mg,利用书写顺序及原子守恒,写成氧化物形式为:2CaO5MgO8SiO2H2O,故答案为:2CaO5MgO8SiO2H2O。
III、(1)根据c=![]() 计算出浓硫酸的浓度为
计算出浓硫酸的浓度为![]() =18.4mol/L,根据稀释定律c(浓)V(浓)=c(稀)V(稀),即有18.4mol/L×V=1.0mol/L×0.5L,解得V=0.0272L=27.2mL;故答案为:27.2;
=18.4mol/L,根据稀释定律c(浓)V(浓)=c(稀)V(稀),即有18.4mol/L×V=1.0mol/L×0.5L,解得V=0.0272L=27.2mL;故答案为:27.2;
(2)①用量筒量取浓硫酸后洗涤量筒,但洗涤液不能转移到容量瓶中,否则溶质偏多,则浓度偏高;故答案为:偏高;
②向容量瓶加水定容时眼睛俯视液面,则溶液体积偏小,则浓度偏高;故答案为:偏高。

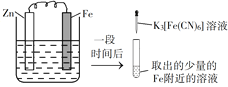
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼