题目内容
【题目】铝是最重要的金属之一,铝及其化合物在生活中有广泛的用途。
(1)纳米铝粉可以作高效催化剂、导电膜层、高档金属颜料等。普通铝在空气中能稳定存在,而纳米铝粉在空气中能自燃,从影响反应速率的角度分析其原因是________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①该反应的化学方程式为_________________。
②MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体。该反应的离子方程式是_____________,该反应中还原剂是___________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
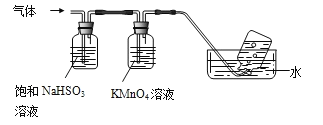
①集气瓶中收集到的气体是_________(填化学式)。
②B中酸性KMnO4溶液褪色(MnO4—还原为Mn2+),发生反应的离子方程式为__________。
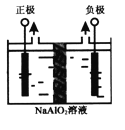
(4)Al(OH)3是重要化工原料。电解法制备高品质Al(OH)3的装置如图(中间用离子交换膜隔开),电解总反应方程式为4NaAlO2+10H2O![]() 4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
【答案】纳米铝粉的表面积大,与氧气的接触更加充分 3MnO2+4Al![]() 3Mn+2A12O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O H2O2 N2 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ 4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑
3Mn+2A12O3 MnO2+H2O2+2H+=Mn2++O2↑+2H2O H2O2 N2 5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ 4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑
【解析】
(1)纳米铝粉的表面积比普通铝大,与氧气的接触更加充分,所以纳米铝粉在空气中能自燃,故答案为:纳米铝粉的表面积大,与氧气的接触更加充分;
(2)①高温时,铝与二氧化锰发生铝热反应生成锰和氧化铝,反应的方程式为3MnO2+4Al![]() 3Mn+2A12O3,故答案为:3MnO2+4Al
3Mn+2A12O3,故答案为:3MnO2+4Al![]() 3Mn+2A12O3;
3Mn+2A12O3;
②由题意,MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体,说明Mn元素化合价降低被还原,MnO2做氧化剂被还原为Mn2+,氧元素化合价升高被氧化,H2O2做还原剂被氧化生成氧气,反应的化学方程式为MnO2+H2O2+2H+=Mn2++O2↑+2H2O,故答案为:MnO2+H2O2+2H+=Mn2++O2↑+2H2O;H2O2;
(3)①由装置图可知,NH4Al(SO4)2·12H2O煅烧分解生成的气体中,NH3和SO3被饱和亚硫酸钠吸收,二氧化硫被高锰酸钾吸收,所以最后集气瓶中收集到的气体是N2,故答案为:N2;
②SO2具有还原性,高锰酸钾具有氧化性,二者发生氧化还原反应生成SO42-和Mn2+离子,反应的方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,故答案为:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+;
(4)由电解总方程式可知,电解偏铝酸钠溶液制取氢氧化铝时,阳极上水电离出的氢氧根放电生成氧气,破坏水的电离平衡生成氢离子,氢离子与偏铝酸根及水生成氢氧化铝沉淀,电极反应式为4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑,故答案为:4AlO2-+6H2O-4e-=4Al(OH)3↓+O2↑。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】在高温下,Fe 与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe 与水蒸气反应的实验"。请回答该实验中的问题。

(1)写出该反应的化学方程式__________。
(2)实验前必须对整套装置进行的操作是___________;
(3)在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。

①实验中使用肥皂液的作用是_____________________________。
②甲同学为探究实验后试管内的固体X中含有哪些物质,进行了下列实验。
实验 编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质是__________________________;不能确定是否存在FeO的原因是____________________________________。
③如果黑色粉末是Fe3O4,则黑色粉末和盐酸反应得离子方程式为________________。