题目内容
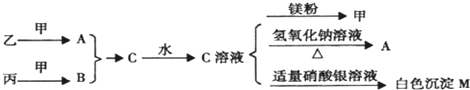
在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)A.相对平均分子质量增大 B.NO2的转化率提高
C.NO2的质量分数增大 D.反应放出的总热量大于原来的2倍
C
解析:将该题过程处理为以下图示:
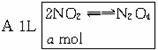

恒温恒容下,状态Ⅰ、Ⅱ、Ⅲ为等效平衡,状态Ⅳ为状态Ⅱ、Ⅲ的简单混合,即化学平衡不移动,则状态Ⅳ的转化率NO2的质量分数,相对平均分子质量与状态Ⅰ相等,反应放出的热量是状态Ⅰ的两倍,从状态Ⅳ到状态Ⅴ相当于加压,平衡向正反应方向移动,则NO2的质量分数会减少,NO2的转化率会提高,混合物平均相对分子质量会增大。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )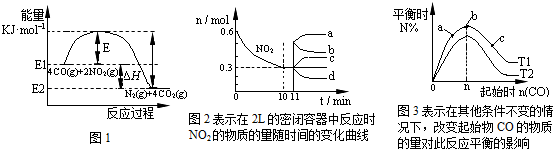

| A、在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | B、由图1可得加入适当的催化剂,E和△H都减小 | C、图2中0~10min内该反应的平均速率v(CO)=0.03mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |