题目内容
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
| A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z) |
| B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应 |
| C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z |
| D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液 |
B
试题分析:根据X、Y、Z、W 属于同周期的短周期主族元素,W的内层电子数比最外层电子数多,说明这四种元素为第三周期元素,Y原子最外层电子数是X原子最外层电子数的3倍,则X为Na元素、Y为Al元素,则Z、W的最外层电子数之和为13,则Z为S元素、W为Cl元素。A、简单离子半径大小,S2?半径大于Cl?半径,所以r(Z) > r(W),错误;B、X、Y、Z最高价氧化物的水化物分别为NaOH、Al(OH)3、H2SO4,Al(OH)3为两性氢氧化物,故两两之间可以发生反应,正确;C、没有指明氧化物水化物是否为最高价,酸性强弱无法比较,错误;D、甲物质由Y和Z元素组成,为Al2S3,溶于水后发生完全水解反应,得不到Al2S3溶液,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
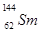 与
与 的说法正确的是
的说法正确的是