题目内容
(2009?广东)常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是( )
分析:根据氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,结合具体的化学反应来解答.
解答:解:A.由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故A错误;
B.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,溶液pH值不变,故B错误;
C.H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,故C正确;
D.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选:CD.
B.将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,溶液pH值不变,故B错误;
C.H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,故C正确;
D.因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,故D正确.
故选:CD.
点评:本题考查氧化还原反应,明确反应中氧化性的比较规律及两个化学反应的关系及催化剂在反应在的作用即可解答,难度不大.

练习册系列答案
相关题目
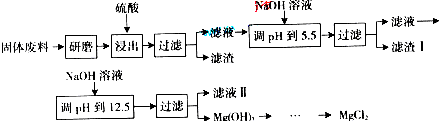

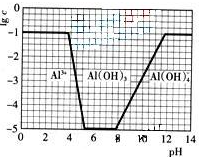 (2009?广东)超细氧化铝是一种重要的功能陶瓷原料.
(2009?广东)超细氧化铝是一种重要的功能陶瓷原料. Al2O3+3H2O↑+2CO2↑+2NH3↑
Al2O3+3H2O↑+2CO2↑+2NH3↑