题目内容
(2009?广东)某工厂生产硼砂过程中产生的固体废料,主要含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3等,回收其中镁的工艺流程如下:
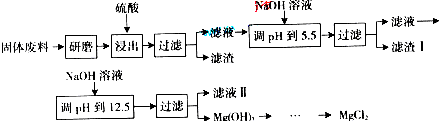
部分阳离子以氢氧化物形式完全深沉时溶液的pH由见上表,请回答下列问题:
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
(2)滤渣I的主要成分有
(3)从滤液Ⅱ中可回收利用的主要物质有
(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
(1)“浸出”步骤中,为提高镁的浸出率,可采取的措施有
升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
升高温度、搅拌、过滤后再向滤渣中加入硫酸(多次浸取)
(要求写出两条).(2)滤渣I的主要成分有
Fe(OH)3 Al(OH)3
Fe(OH)3 Al(OH)3
.(3)从滤液Ⅱ中可回收利用的主要物质有
Na2SO4
Na2SO4
.(4)Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备:
MgCl2+2NaClO3═Mg(ClO3)2+2NaCl
已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:

①将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2.简述可制备Mg(ClO3)2的原因:
在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别.
在某一时NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化最大;NaCl 的溶解度与其他物质的溶解度有一定的差别.
.②按①中条件进行制备实验.在冷却降温析出Mg(ClO3)2过程中,常伴有NaCl析出,原因是:
降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低,会少量析出
降温前溶液中NaCl以达饱和;降低过程中NaCl溶解度会降低,会少量析出
.除去产品中该杂质的方法是:重结晶
重结晶
.分析:(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;
(2)根据MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成滤渣;滤液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3、Al(OH)3;
(3)上述过滤后滤液中阴离子主要是SO42-,加入NaOH后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是Na2SO4;
(4)①根据侯德榜制碱法生成NaHCO3的原理;
②根据侯德榜制碱法生成NaHCO3的原理.
(2)根据MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成滤渣;滤液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3、Al(OH)3;
(3)上述过滤后滤液中阴离子主要是SO42-,加入NaOH后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是Na2SO4;
(4)①根据侯德榜制碱法生成NaHCO3的原理;
②根据侯德榜制碱法生成NaHCO3的原理.
解答:解:(1)浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,
故答案为:适当提高反应温度、增加浸出时间(或其他合理答案);
(2)因MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成滤渣;滤液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(3)上述过滤后滤液中阴离子主要是SO42-,加入NaOH后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是Na2SO4,故答案为:Na2SO4;
(4)①反应MgCl2+2NaClO3═Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行,
故答案为:在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;NaCl 的溶解度与其他物质的溶解度有一定的差别;
②同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠.由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离.故答案为:降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低,会少量析出;重结晶.
故答案为:适当提高反应温度、增加浸出时间(或其他合理答案);
(2)因MgCO3、CaMg(CO3)2、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、CaSO4、Al2(SO4)3和Fe2(SO4)3,其中CaSO4微溶,形成滤渣;滤液中含有MgSO4、Al2(SO4)3和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣I的主要成分是Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(3)上述过滤后滤液中阴离子主要是SO42-,加入NaOH后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是Na2SO4,故答案为:Na2SO4;
(4)①反应MgCl2+2NaClO3═Mg(ClO3)2+2NaCl类似于侯德榜制碱法生成NaHCO3的原理,因为NaCl溶解度小而从溶液中析出,使反应向生成Mg(ClO3)2的方向进行,
故答案为:在某一温度时,NaCl最先达到饱和析出;Mg(ClO3)2的溶解度随温度变化的最大;NaCl 的溶解度与其他物质的溶解度有一定的差别;
②同样是依据①的原理,在降温的过程中,Mg(ClO3)2的溶解度不断减小,从溶液中析出,在生成Mg(ClO3)2的过程中NaCl也不断生成,但因溶解度没有增加,所以也伴随Mg(ClO3)2析出;相同温度时氯化钠的溶解度最小,因此在冷却降温析出Mg(ClO3)2过程中一定会析出氯化钠.由于氯酸镁和氯化钠均溶于水,溶于水的可溶性物质一般用结晶和重结晶的方法分离.故答案为:降温前,溶液中NaCl已达饱和;降低过程中,NaCl溶解度会降低,会少量析出;重结晶.
点评:本题考查考生对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;考查考生应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力.

练习册系列答案
相关题目

 (2009?广东模拟)某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
(2009?广东模拟)某课外小组欲通过实验证明方铅矿分解所得白色粉末中含有氧元素,设计以下的实验装置:
