题目内容
【题目】向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,一段时间后,蓝色溶液变为红色浑浊(Cu2O),继续加入H2O2溶液,红色浑浊又变为蓝色溶液,这个反应可以反复多次。下列关于上述过程的说法不正确的是
A. Cu2+是H2O2分解反应的催化剂 B. H2O2只表现了氧化性
C. H2O2的电子式为: ![]() D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
D. 发生了反应Cu2O + H2O2+4H+=2Cu2++3H2O
【答案】B
【解析】A.向CuSO4溶液中加入H2O2溶液,很快有大量气体逸出,同时放热,说明Cu2+是H2O2分解反应的催化剂,故A正确;B.根据“蓝色溶液变为红色浑浊(Cu2O)”,说明铜离子被还原成+1价,H2O2表现了还原性;继续加入H2O2溶液,红色浑浊又变为蓝色溶液,说明发生了反应Cu2O+H2O2+4H+═2Cu2++3H2O,Cu2O中+1价Cu被氧化成+2价Cu2+,H2O2又表现了氧化性,故B错误;C.H2O2属于共价化合物,电子式为: ![]() ,故C正确;D.红色浑浊又变为蓝色溶液,Cu2O中+1价Cu被氧化成+2价Cu2+,发生反应为:Cu2O+H2O2+4H+═2Cu2++3H2O,故D正确;故选B。
,故C正确;D.红色浑浊又变为蓝色溶液,Cu2O中+1价Cu被氧化成+2价Cu2+,发生反应为:Cu2O+H2O2+4H+═2Cu2++3H2O,故D正确;故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
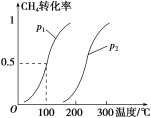
①已知100 ℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为_______。
②图中的p1________p2(填“<”“>”或“=”)。
③该反应的ΔH________0(填“<”“>”或“=”)。
(2)在压强为0.1 MPa条件下,a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0……Ⅱ。
CH3OH(g) ΔH<0……Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=________,b=________。
B.根据反应Ⅱ的特点,如图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=________MPa。

(3)以甲醇作为燃料制成的燃料电池结构示意图如图所示。
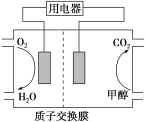
关于该电池的叙述正确的是________。
A.当电池反应消耗了1 mol甲醇时,溶液中转移了12NA个e-
B.电池的负极反应为CH3OH+H2O-6e-===CO2↑+6H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/3 L
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有(请配平)
_____Cl2+ Fe(OH)3+ KOH![]() K2FeO4+ KCl+ H2O
K2FeO4+ KCl+ H2O
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有 Fe3+ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。