题目内容
【题目】甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
CO(g)+3H2(g)……Ⅰ。CH4 的转化率与温度、压强的关系如图。
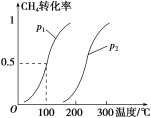
①已知100 ℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为_______。
②图中的p1________p2(填“<”“>”或“=”)。
③该反应的ΔH________0(填“<”“>”或“=”)。
(2)在压强为0.1 MPa条件下,a mol CO与 3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH<0……Ⅱ。
CH3OH(g) ΔH<0……Ⅱ。
①若容器容积不变,下列措施可增加甲醇产率的是________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=________,b=________。
B.根据反应Ⅱ的特点,如图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=________MPa。

(3)以甲醇作为燃料制成的燃料电池结构示意图如图所示。
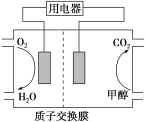
关于该电池的叙述正确的是________。
A.当电池反应消耗了1 mol甲醇时,溶液中转移了12NA个e-
B.电池的负极反应为CH3OH+H2O-6e-===CO2↑+6H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/3 L
【答案】0.003 0 mol/(L·min)<>BD1501/30.1B
【解析】
(1)①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=△c/△t计算v(CH4),利用速率之比等于化学计量数之比计算v(H2)。
②相同温度下,对反应Ⅰ加压,平衡左移,CH4的转化率减小。
③相同压强下,升高温度,甲烷的转化率增大,平衡右移,该反应的正反应为吸热反应。
(2)①a项,由于反应物的总能量大于生成物的总能量,正反应为放热反应,升温,平衡逆向移动;b项,充入He(g),平衡不移动;c项,将H2O(g)从体系中分离出来,减小生成物浓度,平衡正向移动;d项,体积不变,再充入1mol CO2和3 mol H2,相当于增大压强的过程,平衡右移。
②研究合成甲醇的温度和压强的适宜条件,应该固定两种因素,研究一种因素的影响,对比实验1、2中的数据,即研究不同压强对反应的影响;对比实验2、3中的数据,即研究不同温度对反应的影响;根据图像可知,相同温度下,py时CO的转化率大于px时的转化率,再结合反应方程式的特点,找出压强pX和pY大小关系,可求出px数值。
(3)根据燃料电池的电池反应可知,甲醇在负极反应,电极反应式为CH3OH+H2O-6e-===CO2↑+6H+,正极反应式为O2+4e-+4H+===2H2O,根据极反应方程式可以计算出反应电子转移的数目及反应消耗氧气的体积(标况);原电池中电解质溶液中阳离子向正极移动,阴离子向负极移动。
(1)①根据图像,100 ℃达到平衡时CH4的转化率为50%,则平衡时生成H2的物质的量为1.5mol,v(H2)=![]() =0.0030mol/(L·min);正确答案:0.0030 mol/(L·min)。
=0.0030mol/(L·min);正确答案:0.0030 mol/(L·min)。
②相同温度下,对反应Ⅰ加压,平衡左移,CH4的转化率减小,故p1<p2;正确答案:<。
③相同压强下,升高温度,甲烷的转化率增大,平衡右移,该反应的正反应为吸热反应,ΔH>0;正确答案:>。
(2)①反应Ⅱ为气体体积减小的放热反应,降温或加压都可以增加甲醇的产率,但是在容器容积不变的条件下,充入He,使体系总压强增大,由于未影响反应体系中各物质的浓度,平衡不移动,A、C不能增加甲醇的产率;将CH3OH(g)从体系中分离,平衡右移;容器容积不变的条件下,再充入1molCO和3molH2相当于加压,平衡右移,故B、D两选项的措施可以增加甲醇的产率;正确选项BD。
②研究合成甲醇的温度和压强的适宜条件,应该固定两种因素,研究一种因素的影响,对比实验1、2中的数据可知,a=150,即研究不同压强对反应的影响;对比实验2、3中的数据可知,b=1/3,即研究不同温度对反应的影响。相同温度下,py时CO的转化率大于px时的转化率,再结合反应方程式的特点,可知px<py,则px=0.1MPa;正确答案:150;1/3; 0.1。
(3)根据燃料电池的电池反应可知,甲醇在负极反应,电极反应式为CH3OH+H2O-6e-===CO2↑+6H+,正极反应式为O2+4e-+4H+===2H2O,B项正确;当电池反应消耗了2 mol甲醇时,电路中转移了12NA个e-,A项错误;放电过程中,H+从负极区向正极区迁移,C项错误;由电子守恒,每消耗1mol氧气,理论上能生成标准状况下CO2气体44.8/3L,D项错误;正确选项B。




