题目内容
【题目】I、乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻,得知草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应原理为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
学习小组的同学设计了如下滴定方法测定x值:
①称取1.260g草酸晶体,将其制成100.00mL水溶液为待测液;
②取25.00mL待测液放入锥形瓶中,再加入适量的稀硫酸;
③用浓度为0.1000mol·L-1的酸性KMnO4标准溶液进行滴定,达到滴定终点时消耗标准溶液10.00mL。
回答下列问题:
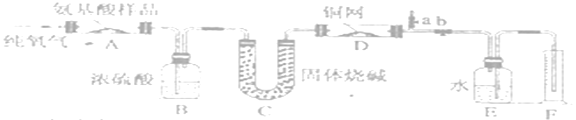
(1)滴定时,将酸性KMnO4标准液装在如图中的___________ (填“甲”或“乙”)滴定管中。

(2)本实验到达滴定终点的标志是________________________________。
(3)通过上述数据,求得x=___________。
(4)若滴定到终点时俯视滴定管刻度线读数,则由此测得的x值会___________(填“偏大”“偏小”或“不变”)。
II、目前已开发出用电解法制取ClO2的新工艺。
(1)图中用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为__________________________。
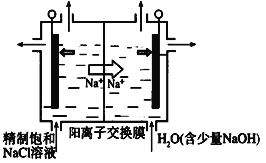
(2)电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol
【答案】 甲 当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色 2 偏大 Cl--5e-+2H2O===ClO2↑+4H+ 0.01
【解析】I、草酸易溶于水,其水溶液可以用酸性KMnO4溶液进行滴定,反应原理为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。学习小组的同学设计了如下滴定方法测定草酸晶体(H2C2O4·xH2O)x值:①称取1.260g草酸晶体,将其制成100.00mL水溶液为待测液;②取25.00mL待测液放入锥形瓶中,再加入适量的稀硫酸;③用浓度为0.1000mol·L-1的酸性KMnO4标准溶液进行滴定,达到滴定终点时消耗标准溶液10.00mL。由化学方程式可知,n(H2C2O4)=![]() n(KMnO4)=
n(KMnO4)=![]() =
=![]() ,则1.260g草酸晶体中n(H2C2O4)=
,则1.260g草酸晶体中n(H2C2O4)=![]() ,m(H2C2O4)=
,m(H2C2O4)=![]() ,m(H2O)=1.260g-0.9000g=0.3600g,n(H2O)=0.0200mol,n(H2C2O4):n(H2O)=1:2,所以x=2。
,m(H2O)=1.260g-0.9000g=0.3600g,n(H2O)=0.0200mol,n(H2C2O4):n(H2O)=1:2,所以x=2。
(1)滴定时,将酸性KMnO4标准液装在酸式滴定管中,选甲滴定管。
(2)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,高锰酸钾溶液是紫色的,反应后,溶液褪色,故不用另外加入指示剂,可以用高锰酸钾溶液本身做指示剂。所以,本实验到达滴定终点的标志是:当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色。
(3)通过上述数据,求得x=2。
(4)若滴定到终点时俯视滴定管刻度线读数,则读数偏小,即高锰酸钾溶液的体积偏小,测得晶体中草酸的含量偏小,则由此测得的x值会偏大。
II、(1)用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为Cl--5e-+2H2O===ClO2↑+4H+。
(2)阴极的电极反应式为2H2O+2e-= H2↑+2OH-,电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,n(H2)=0.005mol,n(e-)=0.01mol,阳离子只有Na+和H+,因此,通过阳离子交换膜的阳离子的物质的量为0.01mol。

【题目】为探究 H2O2、SO2、Br2 氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)
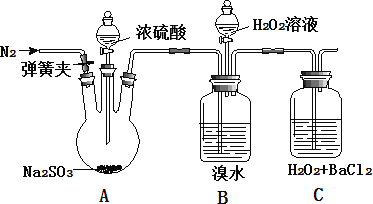
实验操作 | 实验现象 |
i. 打开 A 中分液漏斗活塞,滴加浓硫酸 | A 中有气泡产生,B 中红棕色褪色,C 中有白色沉淀 |
ii. 取 C 中沉淀加入盐酸 | C 中白色沉淀不溶解 |
iii. 打开B 中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加 H2O2 溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A 中发生反应的化学方程式是_____。
(2)B 中红棕色褪色的离子方程式是_____。
(3)甲同学通过 C 中产生白色沉淀,得出结论,氧化性:H2O2>SO2。C 中产生白色沉淀的离子方程式是_____。
①乙同学认为不能得出此结论, 认为在滴加浓硫酸之前应增加一步操作, 该操作是_____。
②丙同学认为还应该在 B 和 C 之间增加洗气瓶 D,D 中盛放的试剂是_____。
③将乙和丙同学改进后的方案进行实验,C 中产生白色沉淀,得出结论:氧化性 H2O2>SO2。
(4)iii 中滴入少量 H2O2 没有明显变化。提出假设:
观点 1:H2O2 的量少不能氧化溴离子
观点 2:B 中有未反应 SO2
为验证观点 2,应进行的实验操作及现象是_____。
(5)通过上述全部实验,得出结论:H2O2、SO2、Br2 氧化性由强到弱的顺序是_____。