题目内容
1.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下11.2LO2和16gO3中含有的O数均为 NA | |
| B. | 32g氧气所含质子数为NA | |
| C. | 1mol/L的CaCl2溶液中含有的Cl-为2NA | |
| D. | 12.6g水所含电子数目为0.7NA |
分析 A、求出氧气的物质的量,然后根据氧气为双原子分子来分析;臭氧由氧原子构成;
B、求出氧气的物质的量,然后根据1mol氧气中含16mol质子来分析;
C、溶液体积不明确;
D、求出水的物质的量,然后根据水为10电子分子来分析.
解答 解:A、标况下11.2L氧气的物质的量为0.5mol,而氧气为双原子分子,故0.5mol氧气中含1mol氧原子即NA个;臭氧由氧原子构成,故16g臭氧中含有的氧原子的物质的量为n=$\frac{16g}{16g/mol}$=1mol,个数为NA个,故A正确;
B、32g氧气的物质的量为1mol,而1mol氧气中含16mol质子,即为16NA个,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、12.6g水的物质的量为0.7mol,而水为10电子分子,故0.7mol水中含7mol电子即7NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
11.下列有关物质性质的应用正确的是( )
| A. | SO2具有漂白性,所以可以使溴水褪色 | |
| B. | 金属钠硬度小、密度小,可用于制造高压钠灯 | |
| C. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| D. | 常温下浓H2SO4和浓HNO3都能使Cu发生钝化 |
9.金属钠投入下列溶液中,溶液质量减轻的是( )
| A. | 盐酸 | B. | 硫酸铜溶液 | C. | 水 | D. | 稀氢氧化钠溶液 |
13.下列实验操作完全正确的是( )
| A. | 酸碱中和滴定曲线绘制实验测试和记录pH的间隔时间要相同 | |
| B. | 配置一定浓度的氯化钾溶液0.1mol/L准确称取氯化钾固体,量筒量取1000ml水倒入容量瓶中,溶解,震荡摇匀,定容 | |
| C. | 排除碱式滴定管尖嘴部分的气泡将胶管弯曲使玻璃尖嘴断向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 | |
| D. | 取出分液漏斗中所需的上层液体下层液体从分液漏斗下端尖口放出,关闭活塞,换一个接受容器,上层液体继续从分液漏斗下端管口放出 |
10.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2 NA | |
| B. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 1molP4和1molCH4所含共价键的数目均为4NA | |
| D. | 1molFe在1molCl2中燃烧,转移3NA个电子 |
11.下列对Na2O2的叙述中,正确的是( )
| A. | Na2O2中氧元素化合价为-1 | |
| B. | Na2O2能与水反应,所以Na2O2可以作气体的干燥剂 | |
| C. | Na2O2与水反应时,Na2O2是氧化剂,水是还原性 | |
| D. | Na2O2与二氧化碳反应时,Na2O2只作氧化剂 |
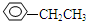 、HCOOH、CH3COOC2H5.
、HCOOH、CH3COOC2H5.