题目内容
10.VmlAl2(SO4)3溶液中,含有Al3+ a g,取$\frac{V}{2}$ml的该溶液稀释到3Vml,则稀释后的溶液中SO42-的物质的量浓度为( )| A. | $\frac{250a}{27V}$ mol/L | B. | $\frac{250a}{9V}$ mol/L | C. | $\frac{500a}{9V}$ mol/L | D. | $\frac{125a}{9V}$ mol/L |
分析 计算出ag铝离子的物质的量,然后根据化学式Al2(SO4)3计算出硫酸根离子的物质的量,从而得出$\frac{V}{2}$mL溶液中含有硫酸根离子得到物质的量,再根据吸收过程中溶质的物质的量不变计算出稀释后溶液中硫酸根离子的浓度.
解答 解:ag铝离子的物质的量为:n(Al3+)=$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,
VmL该溶液中含有硫酸根离子的物质的量为:$\frac{a}{27}$mol×$\frac{3}{2}$=$\frac{a}{18}$mol,
则$\frac{V}{2}$mL溶液中含有硫酸根离子得到物质的量为:$\frac{a}{18}$mol×$\frac{1}{2}$=$\frac{a}{36}$mol,
溶质在稀释过程中溶质的物质的量不变,
所以稀释后溶液中硫酸根离子的物质的量浓度为:c(SO42-)=$\frac{\frac{a}{36}mol}{3V×1{0}^{-3}L}$=$\frac{250a}{27V}$mol/L,
故选B.
点评 本题考查物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确稀释过程中溶质的物质的量不变为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
1.分离氯化铵和氯化钠的最佳方法是( )
| A. | 加入烧碱 | B. | 加热法 | ||
| C. | 加入AgNO3溶液 | D. | 利用溶解度不同,采用结晶法 |
2.在一密闭容器中,反应mA(g)+nB(s)?3C(g)达到平衡时,测得C(A)为0.5mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3mol/L,则下列判断不正确的是( )
| A. | 混合气体密度一定减小 | B. | 平衡一定向逆反应方向移动 | ||
| C. | 化学计量数:m+n<3 | D. | 物质C的体积分数减小了 |
19.下列物质:①氢氟酸;②浓H2SO4;③烧碱溶液;④Na2CO3固体;⑤氧化钙;⑥浓HNO3,其中在一定条件下能与SiO2反应的有( )
| A. | ①②⑥ | B. | ②③⑥ | C. | ①③④⑤ | D. | 全部 |
20.能用离子方程式:CO32-+2H+═CO2↑+H2O来表示的是( )
| A. | 碳酸钡与盐酸反应 | B. | 碳酸钾溶液与醋酸溶液反应 | ||
| C. | 苏打溶液与稀硝酸反应 | D. | 小苏打溶液与稀硫酸反应 |
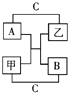 A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
A、B、C是短周期里的3种元素的单质,甲、乙是常见的化合物,它们之间 存在如下关系:若A为单质有色气体,请判断:(填化学式)A是Cl2,B是S,C是H2,甲是H2S,乙是HCl.
 .
.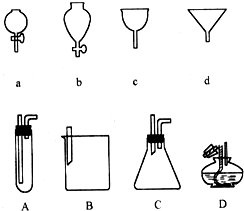 如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.
如图a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,如:C与a组合,用于制取气体.