题目内容
3.下列说法中,正确的是( )| A. | 1771年,法国科学家拉瓦锡发现元素周期律,把化学元素及其化合物纳入一个统一的理论体系 | |
| B. | 化学科学与其他科学分支的联系不密切 | |
| C. | 化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 | |
| D. | 化学家可以在微观层面上操纵分子和原子,组装分子材料、分子器件和分子机器 |
分析 A、元素周期律是门捷列夫提出的;
B、化学科学与其他科学分支的联系密切;
C、化学研究不会造成严重的环境污染;
D、化学家可以在微观层面上操纵分子和原子;
解答 解:A、门捷列夫发现并提出元素周期律,拉瓦锡发现了氧气,故A错误;
B、科学之间相互联系,化学科学与其他科学分支的联系密切,故B错误;
C、只要能合理设计实验路线,化学研究不会造成严重的环境污染,故C错误;
D、科学的发展非常迅速,化学家可以在微观层面上操纵分子和原子,从而用分子或原子来组装分子材料、分子器件和分子机器,故D正确.
故选D.
点评 本题考查化学科学的主要研究对象,难度不大,掌握重要的化学史能激发学生学习化学的兴趣和动力.

练习册系列答案
相关题目
13.下列关于分散系的说法,正确的是( )
| A. | 稀硫酸不是分散系 | |
| B. | 一种分散系里只有分散质和分散剂两种物质 | |
| C. | 分散剂一定是液体 | |
| D. | 按分散质和分散剂的状态(气、液、固)有9种组合方式 |
14.下列反应属于放热反应的是( )
| A. | 木炭与炽热的水蒸气反应制取水煤气 | |
| B. | 铜丝在氯气中燃烧 | |
| C. | 高温煅烧石灰石 | |
| D. | 氢氧化钡晶体与氯化铵固体混合 |
8.下列事实与胶体性质无关的是( )
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 一束平行光线射入蛋白质溶液中,从侧面可以看到一束光亮的通路 | |
| C. | 黄河入海口形成了三角洲 | |
| D. | 将二氧化碳通入澄清石灰水中,一段时间后,石灰水变浑浊 |
15.下列变化过程中,需要加入还原剂的是( )
| A. | MnO2→MnO4- | B. | Al(OH)4-→Al(OH)3 | C. | SO32-→SO42- | D. | MnO2→MnCl2 |
12.某一元强酸稀溶液和某一元弱碱稀溶液等体积混合后,溶液pH等于7.0,则以下叙述正确的是( )
| A. | 酸溶液的物质的量浓度大于碱溶液的物质的量浓度 | |
| B. | 酸溶液中H+的浓度小于碱溶液中0H-的浓度 | |
| C. | 酸和碱混合时,碱过量 | |
| D. | 酸溶液的pH与碱溶液pH之和为14 |
12.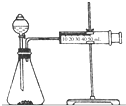 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
