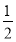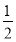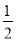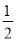题目内容
已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和726.5 kJ·mol-1。请回答下列问题。
(1)用太阳能分解5 mol液态水消耗的能量是 kJ。
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为 。
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为 。
理想状态下,该燃料电池消耗2 mol甲醇所能产生的最大电能为1 404.2 kJ,则该燃料电池的理论效率为 。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
(1)1 429
(2)CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-443.5 kJ·mol-1
(3)O2+4e-+4H+=2H2O 96.6%
【解析】(1)根据能量守恒定律可知分解5 mol液态水消耗的能量与生成5 mol液态水放出的能量相等,285.8 kJ·mol-1×5 mol=1 429 kJ。
(2)2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1 ①
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 453.0 kJ·mol-1 ②
根据盖斯定律(②-①)÷2得:CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-443.5 kJ·mol-1。
(3)甲醇燃料电池的正极反应物为O2,酸性条件下生成H2O:O2+4e-+4H+=2H2O。2 mol甲醇完全燃烧放出的热量为1 453.0 kJ,故该电池的理论效率为1 404.2 kJ÷1 453.0 kJ×100%=96.6%。

某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下某一刻度,并记下读数
④移取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟内不变色。
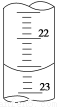
(3)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度为 mol/L
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得不同时间(t)内产生气体体积(V)的数据如图,根据图示分析实验条件,下列说法中一定不正确的是( )
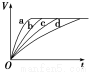
组合 | 对应曲线 | c(HCl)/mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a |
| 30 | 粉末状 |
2 | b |
| 30 | 粉末状 |
3 | c | 2.5 |
| 块状 |
4 | d | 2.5 | 30 | 块状 |
A.第1组实验中盐酸的浓度大于2.5 mol·L-1
B.第2组实验中盐酸的浓度等于2.5 mol·L-1
C.第3组实验的反应温度低于30 ℃
D.第4组实验的反应速率最慢