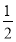题目内容
已知断裂1 mol H2和1 mol Cl2中的化学键吸收的能量分别为436 kJ、243 kJ,而由H
原子和Cl原子形成1 mol HCl时释放的能量为431 kJ。则下列热化学方程式中正确的是( )
A.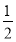 H2(g)+
H2(g)+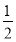 Cl2(g)=HCl(g) ΔH=-183 kJ·mol-1
Cl2(g)=HCl(g) ΔH=-183 kJ·mol-1
B.H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1
C.HCl(g)= 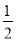 H2(g)+
H2(g)+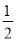 Cl2(g) ΔH=-91.5 kJ·mol-1
Cl2(g) ΔH=-91.5 kJ·mol-1
D.H2(g)+Cl2(g)=2HCl(g) ΔH=+248 kJ·mol-1
B
【解析】H2与Cl2反应的化学方程式为H2(g)+Cl2(g)=2HCl(g),该反应的反应热ΔH=436 kJ·mol-1+243 kJ·mol-1-2×431 kJ·mol-1=-183 kJ·mol-1,故反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-183 kJ·mol-1,A错误,B正确。HCl分解是吸热反应,C错误。D的计算过程是ΔH=436 kJ·mol-1+243 kJ·mol-1-431 kJ·mol-1=+248 kJ·mol-1,忽视了生成物中HCl为2 mol,因此是错误的。

练习册系列答案
相关题目