题目内容
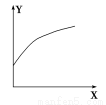
溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
=0.100 mol/L、c(B)=0.200 mol/L及c(C)=0 mol/L。反应物A的浓度随时间的变化如图所示。

请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
② ;
③ 。
(2)实验②平衡时B的转化率为 ;实验③平衡时C的浓度为 。
(3)该反应的ΔH 0,其判断理由是 。
(4)该反应进行到4.0 min时的平均反应速率:
实验②:v(B)= 。
实验③:v(C)= 。
(1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变 ③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4) 0.06 mol/L;
(3)> 升高温度向正方向移动,故该反应是吸热反应
(4)0.014 mol(L·min)-1 0.0089 mol(L·min)-1
【解析】(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比达平衡所需时间短,平衡时浓度更小,故不可能是改用催化剂,而只能是升高温度来影响反应速率的。
(2)不妨令溶液为1 L,则②中达平衡时A转化了0.04 mol,由反应计量数可知B转化了0.08 mol,所以B转化率为40%(或0.4);同样在③中A转化了0.06 mol,则生成C为0.06 mol,体积不变,即平衡时c(C)=0.06 mol/L。
(3)ΔH>0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,ΔH>0。
(4)从图上读数,进行到4.0 min时,实验②的A的浓度为:0.072 mol/L,则Δc(A)=0.10-0.072=0.028 mol/L,v(A)= =0.007 mol·L-1·min-1则vB=2 vA=2×0.007=0.014 mol·L-1·min-1;进行到4.0 min实验③的A的浓度为:0.064 mol/L;Δc(A)=0.10-0.064=0.036 mol/L,ΔVA=
=0.007 mol·L-1·min-1则vB=2 vA=2×0.007=0.014 mol·L-1·min-1;进行到4.0 min实验③的A的浓度为:0.064 mol/L;Δc(A)=0.10-0.064=0.036 mol/L,ΔVA= =0.009 mol·L-1·min ΔVA=ΔVC。
=0.009 mol·L-1·min ΔVA=ΔVC。

 名校课堂系列答案
名校课堂系列答案活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和
活性炭(无杂质),生成气体E和F。当温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
物质 n/mol T/℃ | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式: 。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1= 。
②根据上述信息判断,T1和T2的关系是 (填序号)。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是 (填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F