题目内容
(2012?丹东模拟)下列实验原理、装置、试剂选用、结论正确的是( )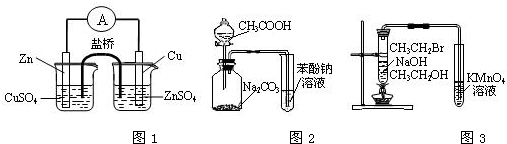

分析:A.试纸湿润,测得盐酸的pH偏大;
B.左端烧杯发生置换反应,不能形成原电池;
C.根据强酸制取弱酸的反应原理来分析;
D.乙醇易挥发,且乙醇也能被高锰酸钾氧化.
B.左端烧杯发生置换反应,不能形成原电池;
C.根据强酸制取弱酸的反应原理来分析;
D.乙醇易挥发,且乙醇也能被高锰酸钾氧化.
解答:解:A.用湿润的pH试纸测定稀盐酸的pH,相当于盐酸稀释,测得盐酸的pH偏大,故A错误;
B.左端烧杯发生置换反应,整个装置不能形成电势差,则不能形成原电池,故B错误;
C.由醋酸和碳酸钠溶液反应生成碳酸,碳酸与苯酚钠溶液反应生成苯酚可知,酸性为CH3COOH>H2CO3>C6H5OH,故C正确;
D.乙醇易挥发,且乙醇也能被高锰酸钾氧化,则使高锰酸钾褪色的可能为乙醇,也可能为溴乙烷的消去产物(乙烯),故D错误;
故选C.
B.左端烧杯发生置换反应,整个装置不能形成电势差,则不能形成原电池,故B错误;
C.由醋酸和碳酸钠溶液反应生成碳酸,碳酸与苯酚钠溶液反应生成苯酚可知,酸性为CH3COOH>H2CO3>C6H5OH,故C正确;
D.乙醇易挥发,且乙醇也能被高锰酸钾氧化,则使高锰酸钾褪色的可能为乙醇,也可能为溴乙烷的消去产物(乙烯),故D错误;
故选C.
点评:本题考查实验方案的评价,明确pH的测定、原电池的形成、强酸制取弱酸的原理、有机物的性质即可解答,题目难度不大,选项B为易错点.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
 (2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.
(2012?丹东模拟)能源短缺是人类面临的重大问题.甲醇是一种可再生能源.具有广泛的开发和应用前景.因此甲醇被称为21世纪的新型燃料.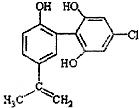 (2012?丹东模拟)某种兴奋剂的结构如图所示,下列说法正确的是( )
(2012?丹东模拟)某种兴奋剂的结构如图所示,下列说法正确的是( )