题目内容
下列排列顺序正确的是( )
| A.热稳定性强弱:HCl>HBr>HI | B.微粒半径:C1->K+>Na+>Fe(OH)3胶粒 |
| C.晶体熔点:SiO2>NaCl>CF4>CCl4 | D.氢化物的沸点:H2Se>H2S>H2O |
A
解析试题分析:A选项半径越小其对应的氢化物稳定性就越强,因此A选项是正确的。 B选项电子层数相同时,半径随原子序数的增大而减小,所以B选项是错误的。C选项原子晶体的熔点大于离子晶体大于分子晶体,而同样是分子晶体的,其相对分子质量越大,则它们之间的范德华力就越大,因此熔点就越高,所以C选项中应该是CCl4大于CF4所以C选项是错误的。D选项水中会存在氢键,因此水的沸点肯定比硫化氢高,所以D选项是错误的,故答案选A
考点:考查元素周期律及半径大小的比较、晶体熔点的比较的相关知识点

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
XY2是由短周期元素形成的化合物,Y-比X2+多一个电子层,且与氩原子的电子层结构相同。下列有关叙述不正确的是( )
| A.X是第二周期元素 | B.Y是第ⅦA族元素 |
| C.Y-与X2+的最外层电子数相同 | D.化合物XY2的化学键为离子键 |
短周期元素W、X、Y、Z在元素周期表中的位置如下图所示。下列说法正确的是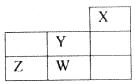
| A.W的非金属性比Z的弱 | B.W的最高价氧化物对应的水化物是强酸 |
| C.Y的原子半径在同周期主族元素中最大 | D.Z的气态氢化物的稳定性在同主族元素中最强 |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |
两种微粒含有相同的质子数和电子数,这两种微粒可能是
①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子;④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子;⑦两种不同阳离子;⑧两种不同阴离子;⑨一种阴离子和一种阳离子
| A.①③⑤⑥⑦⑧ | B.①③⑤⑦⑧ |
| C.①③④⑤⑦ | D.全部都是 |
核磁共振技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核才有此性质。下列原子可产生核磁共振现象的是
| A.18O | B.28Si | C.32S | D.40K |
1919年,科学家第一次实现了人类多年的梦想——人工转变元素。这个核反应如下: N+
N+ He―→
He―→ O+
O+ H,下列叙述正确的是( )
H,下列叙述正确的是( )
A. O原子核内有9个质子 O原子核内有9个质子 |
B. H原子核内有1个中子 H原子核内有1个中子 |
| C.O2和O3互为同位素 |
| D.通常情况下,He和N2化学性质都很稳定 |
某元素原子价电子构型3d54s2,其应在( )
| A.第四周期ⅡA族 | B.第四周期ⅡB族 |
| C.第四周期ⅦA族 | D.第四周期ⅦB族 |

