题目内容
在150℃,101Kpa下由HCHO、H2和CO三种气体组成的混合气体共6.72g,其相对氢气的密度14,将该气体与足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为( )
分析:H2和CO与氧气反应生成二氧化碳和水,二氧化碳和水与过氧化钠反应,都使Na2O2粉末增重,根据方程式可知,二氧化碳与过氧化钠反应增重为开始CO的质量,水与过氧化钠反应增重为开始H2的质量,HCHO(g)与氧气反应生成二氧化碳和水,HCHO相当于H2和CO按1:1混合,其燃烧生成二氧化碳和水,所以使Na2O2粉末增重为HCHO的质量.
解答:解:混合气体相对氢气的密度为14,所以混合气体平均摩尔质量为2g/mol×14=28g/mol,6.72g混合气体的物质的量为
=0.24mol,在氧气足量时,全部发生反应生成二氧化碳和水,根据方程式2CO+O2
2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2
2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量,甲醛可以看成是一氧化碳和氢气的混合物,所以甲醛与足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为甲醛的全部质量,即当HCHO、H2和CO三种气体组成的混合气体足量的氧气充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为混合气体的总质量.
故选:A.
| 6.72g |
| 28g/mol |
| ||
| ||
故选:A.
点评:本题考查混合物的计算,难度中等,注意从CO2、H2O与Na2O2生成固体质量的变化分析规律,此为解答该题的关键.

练习册系列答案
相关题目
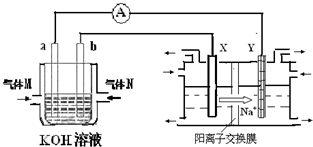 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.