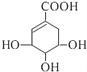
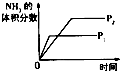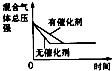��Ŀ����
����Ŀ�����ݻ�Ϊ1.00L�������У�ͨ��һ������N2O4 �� ������ӦN2O4��g��2NO2��g�������¶����ߣ�����������ɫ����ش��������⣺
��1����Ӧ�ġ�H0������ڡ���С�ڡ�����100��ʱ����ϵ�и�����Ũ����ʱ��仯��ͼ��ʾ����0��60sʱ�Σ���Ӧ����v��N2O4��Ϊ molL��1s��1
��2��100��ʱ��ƽ��ı䷴Ӧ�¶�ΪT��c��N2O4����0.002 0molL��1s��1��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⣮T100�棨����ڡ���С�ڡ������ж������� ��
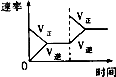
��3���¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�룮ƽ�����������Ӧ�����淴Ӧ���������ƶ����ж������� ��
���𰸡�
��1����,0.0010
��2����,�ı��¶Ⱥ�,N2O4Ũ�ȼ�С,��Ӧ�������,��������,���¶�����
��3���淴Ӧ,������������,����ѹǿ,ƽ�������������С�ķ����ƶ�
���������⣺��1�����¶ȵ����ߣ�����������ɫ�����ѧƽ��������Ӧ�����ƶ�������H��0��0��60sʱ�Σ�N2O4Ũ�ȱ仯Ϊ��0.1mol/L��0.04mol/L=0.06mol/L��v��N2O4��= ![]() =0.0010molL��1s��1��
=0.0010molL��1s��1��
�ʴ�Ϊ������0.0010molL��1s��1��
��2��N2O4��Ũ�Ƚ��ͣ�ƽ��������Ӧ�����ƶ�����������Ӧ�������ȣ�T��100�棬
�ʴ�Ϊ�������ı��¶Ⱥ�c��N2O4������ƽ�������ƶ�������ӦΪ���ȷ�Ӧ�����¶����ߣ�
��3����Ӧ�������ݻ�����һ�룬ѹǿ��������Ӧ�������������������ѹǿ�������������С�ķ����ƶ���
�ʴ�Ϊ���淴Ӧ�������������䣬����ѹǿ��ƽ�������������С�ķ����ƶ���
��1���¶����ߣ���ɫ���ƽ��������Ӧ�����ƶ����ݴ��ж��ʱ䣻���ݷ�Ӧ���ʵĶ�����㷴Ӧ���ʣ�
��2�������¶ȶԻ�ѧƽ���Ӱ������жϣ�
��3������ѹǿ�Ի�ѧƽ���Ӱ������ж�.

����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ������ǣ�������
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A.A
B.B
C.C
D.D
����Ŀ����ӦmA(g)+nB(g) ![]() pC(g)��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±���ʾ��
pC(g)��һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±���ʾ��
ѹǿ/Pa | 2��105 | 5��105 | 1��106 |
c(A)/(mol��L-1) | 0.08 | 0.20 | 0.44 |
�����������ݣ��ش�
��1����ѹǿ��2��105 Pa���ӵ�5��105 Paʱ��ƽ��(��������ҡ�����)�ƶ�����������
��2����ѹǿ��5��105 Pa���ӵ�1��106 Paʱ���÷�Ӧ�Ļ�ѧƽ���ƶ����жϵ������� �� ���ܵ�ԭ������