题目内容
【题目】将 4 molA气体和3molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
2C(g), 若经 2 s后测得 C的浓度为 0.6 molL-1,现有下列几种说法:
①用物质A 表示反应的平均速率为 0.3 molL-1s-1
②物质 B的体积分数是40%
③2 s 时物质 A 的转化率为30%
④2 s 时物质 B 的浓度为 1.0 molL-1
其中正确的是
A. ①④ B. ②③ C. ①③ D. ③④
【答案】C
【解析】试题分析:利用三段式分析
2A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol/L) 2 1.5 0
转化浓度(mol/L) 0.6 0.3 0.6
2s后浓度(mol/L) 1.4 1.2 0.6
①用物质A表示的反应的平均速率为0.6mol/L÷2s=0.30.3 molL-1s-1,正确;②物质 B的体积分数是1.2/(1.2+1.4+0.6)×100%=54.5%,错误;③2 s 时物质 A 的转化率为0.6/2×100%=30%,正确;④2 s 时物质 B 的浓度为 1.2molL-1,错误,选C。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
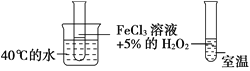
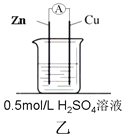
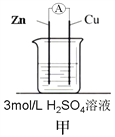
【题目】为了探究影响化学反应速率的因素,现设计如图所示两组对比试验
第1组 | 第2组 |
|
|
(1)第1组:实验目的是探究________对化学反应速率的影响。
(2)第2组:甲中电流表指针偏转程度更大,说明反应物浓度越大,化学反应速率_____。
(3)第2组甲中能量转化的形式是______________(填“电能转化为化学能”或“化学能转化为电能”),锌片________(填“失去”或“得到”)电子,当放出3.36L(标准状况)气体时,理论上消耗的锌的质量是________g,通过导线的电子有___________mol 。